Oxymerkurace
Oxymerkurace je označení pro elektrofilní adice přeměňující alkeny na alkoholy, kde alken reaguje s vodným roztokem octanu rtuťnatého (AcO–Hg–OAc) za navázání acetoxyrtuťnaté (HgOAc) a hydroxylové (OH) skupiny na dvojnou vazbu. Při této reakci nevznikají karbokationty a nedochází tak k přesmykům. Reakce probíhá podle Markovnikovova pravidla (hydroxylová skupina se navazuje na více substituovaný uhlík) a jedná se o anti-adici (obě skupiny se vážou ve vzájemné poloze trans).[2][3][4]
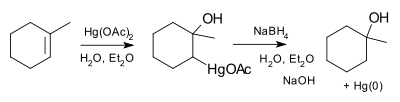
Oxymerkurace, po kterých následují redukční demerkurace, se nazývají oxymerkuračně–redukční nebo oxymerkuračně–demerkurační reakce. Tyto reakce se provádějí mnohem častěji než samotné oxymerkurace.
Mechanismus

Průběh obecné oxymerkurace lze rozdělit do tří částí. V prvním kroku nukleofilní dvojná vazba atakuje rtuťnatý kation, čímž dochází k odštěpení acetoxylové skupiny. Volný elektronový pár na rtuťnatém iontu reaguje s uhlíkem dvojné vazby za vzniku merkuroniového iontu, ve kterém má atom rtuti kladný náboj. Elektrony v nejvyšším obsazeném molekulovém orbitalu dvojné vazby jsou dodány do prázdného 6s orbitalu atomu rtuti a elektrony v dxz (nebo dyz) orbitalu se dostanou do nejnižšího neobsazeného molekulového orbitalu dvojné vazby.
Ve druhém kroku molekula vody nukleofilně atakuje substituovanější atom uhlíku, čímž uvolní elektrony vytvářející jeho vazbu se rtutí. Elektrony se spojí se rtuťnatým iontem a zneutralizují jej. Kladný náboj se v tomto okamžiku nachází na atomu kyslíku z molekuly vody.
Ve třetím kroku acetoxylový anion odštěpený v prvním kroku reaguje s vodíkem z molekuly vody, čímž vytvoří kyselinu octovou jako vedlejší produkt. Dva elektrony účastnící se vazby mezi a atakovaným vodíkem se spojí s kyslíkem, který se tak stane neutrálním a vytvoří se alkohol, který je konečným produktem.
Regioselektivita a stereochemie
Oxymerkurace jsou vysoce regioselektivní a probíhají podle Markovnikovova pravidla; mimo některé krajní případy voda vždy přednostně reaguje s více substituovaným uhlíkem a hydroxylová skupina se tak navazuje na něj. Tuto vlastnost lze vysvětlit po prozkoumání trojice rezonančních struktur merkuroniového iontu utvořeného na konci prvního kroku.
Z těchto struktur vyplývá, že se kladný náboj z atomu rtuti někdy (kolem 4 procent času) nachází na více substituovaném uhlíku. Tímto vzniká dočasný terciární karbokation, který je vysoce reaktivním elektrofilem. Nukleofil tak bude s merkuroniovým iontem reagovat v tomto okamžiku. Nukleofil tak více reaguje s tímto atomem uhlíku, protože má silnější kladný náboj než méně substituovaný uhlík.
Z hlediska stereochemie je oxymerkurace anti-adicí. V druhém kroku nukleofil nemůže ze sterických důvodů s uhlíkovým atomem reagovat na stejné straně jako rtuťnatý ion, jelikož zde není dostatek místa pro současnou přítomnost rtuťnatého iontu a nukleofilu. Pokud tedy není možná volná rotace, tak budou hydroxylová a acetoxymerkuriová skupina vzájemně v poloze trans.
Níže jsou zobrazeny příklady regioselektivity a stereospecifity oxymerkuračních reakcí substituovaných cyklohexenů. Objemné skupiny, jako je například terc-butyl, uzavírají kruh v židličkové konformaci. U 4-terc-butylcyklohexenu mohou oxymerkurací vzniknout dvě různé sloučeniny – pokud adice probíhá na dvojné vazbě, je vždy typu anti – přičemž převládá navazování acetoxyHg skupin do polohy trans vůči terc-butylové skupině, takže mírně převažuje cis-produkt. V případě 1-methyl-4-terc-butylcyklohexenu se tvoří pouze jeden produkt – pořád jde o anti-adici na dvojnou vazbu –kde se voda váže pouze na více substituovaný atom uhlíku. Příčinou anti-adice na dvojnou vazbu je maximalizování překryvu volného elektronového páru vody a prázdného orbitalu merkuroniového iontu na opačné straně acetoxyHg skupiny. Regioselektivita je řízena ve prospěch reakce vody se substituovanějším uhlíkem, k adici ale nedochází v poloze syn, což naznačuje, že přechodný stav je vodou atakován převážně z opačné strany.[5]
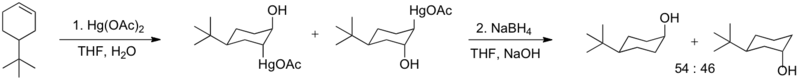
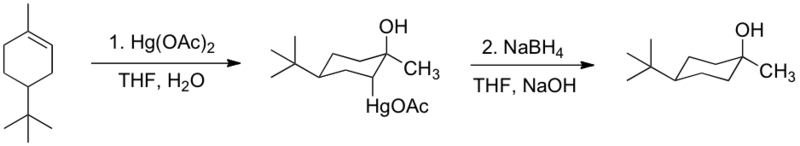
Oxymerkurace–redukce
Produkty oxymerkuračních reakcí jsou téměř vždy působením borohydridu sodného (NaBH4) v zásaditém prostředí demerkurovány. Při demerkuracích, patřících mezi redukční eliminace, jsou acetoxyrtuťnaté skupiny nahrazovány atomy vodíku; na tyto reakce nemá vliv stereochemie reaktantů.[6]
Provedení oxymerkurace následované demerkurací se nazývá oxymerkuračně–redukční reakce.[7] Oxymerkuračně-redukční reakce v souhrnu představují samotné navázání vody na dvojné vazby. Jakákoliv stereochemie vytvořená během oxymerkurace je při demerkuraci zrušena, vodík a hydroxyl tak mohou být vůči sobě v poloze cis i trans. Oxymerkurace je v laboratořích často používaným způsobem hydratace alkenů s markovnikovovskou selektivitou, protože se při ní nevytvářejí karbokationtové meziprodukty a nedochází tedy k přesmykům, jež by mohly mít za následek složité směsi produktů.
Ostatní použití
Oxymerkurace nejsou omezeny jen na reakce alkenů s vodou za účelem navazování hydroxylových skupin a rtuti. Ve vazbě s uhlíkem může být rtuť snadno nahrazena vodíkem namísto provádění samostatného redukčního kroku. Rtuť tak tuto reakci katalyzuje jako Lewisova kyselina.
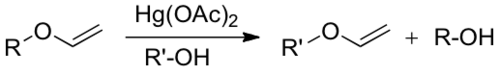
Při použití alkynových substrátů namísto alkenů vznikají enoly, které se následně tautomerují na ketony. Je-li místo vody použit alkohol, pak dojde k tvorbě etheru. Obě tyto reakce probíhají podle Markovnikovova pravidla.

Při reakcích vinyletherů za přítomnosti alkoholů se nahrazují alkoxyskupiny (RO–) jinými, přičemž takové reakce probíhají přes acetalové meziprodukty. Allylalkoholy s vinylethery dávají sloučeniny s obecným vzorcem R–CH=CH–CH2–O–CH=CH2, vhodné k zaojení do Claisenových přesmyků.[8]

Odkazy
Související články
- Hydroboračně-oxidační reakce
- Mukaijamova hydratace
Reference
V tomto článku byl použit překlad textu z článku Oxymercuration reaction na anglické Wikipedii.
- Organic Syntheses. www.orgsynth.org [online]. [cit. 2022-03-26]. Dostupné online. (anglicky)
- Marc G. Loudon. Organic Chemistry. [s.l.]: Oxford University Press, 2002. Dostupné online. Kapitola Addition Reactions of Alkenes, s. 165-168.
- McGraw-Hill Higher Education. Oxymercuration–Demercuration of Alkenes. [s.l.]: [s.n.], 2000. Dostupné online.
- Andreas Schleifenbaum. Reaktionen, Reagenzien und Prinzipien. [s.l.]: [s.n.], 2001. Dostupné v archivu pořízeném dne 2004-08-29. Kapitola Oxymercuration.
- D. J. Pasto; J. A. Gontarz. Studies on the Mechanism of the Oxymercuration of Substituted Cyclohexenes. Journal of the American Chemical Society. 1971, s. 6902–6908.
- George M. Whitesides; Joseph San Filippo. Mechanism of reduction of alkylmercuric halides by metal hydrides. Journal of the American Chemical Society. 1970, s. 6611–6624. DOI 10.1021/ja00725a039.
- Frederick G. Bordwell; Miriam L. Douglass. Reduction of Alkylmercuric Hydroxides by Sodium Borohydride. Journal of the American Chemical Society. 1966, s. 993–999.
- J. E. McMurry; A. Andrus; G. M. Ksander; J. H. Muesser; M. A. Johnson. Stereospecific Total Synthesis of Aphidicolin. Journal of the American Chemical Society. 1979, s. 1330–1332. DOI 10.1021/ja00725a039.