Elektrofilní halogenace
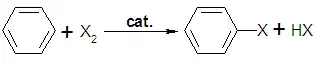
Elektrofilní halogenace je jedním z druhů elektrofilní aromatické substituce a také halogenace. Tato reakce je typická pro aromatické sloučeniny a je velmi užitečným způsobem zavedení substituentů do aromatických systémů.
U některých aromatických sloučenin, například fenolu, tato reakce probíhá bez katalyzátoru, ale u většiny derivátů benzenu s méně reaktivními substráty je potřeba použít Lewisovu kyselinu jako katalyzátor. Nejčastěji se takto používají AlCl3, FeCl3, FeBr3 a ZnCl2. Během katalyzované reakce vzniká značně elektrofilní komplex, jenž je atakován benzenovým jádrem.
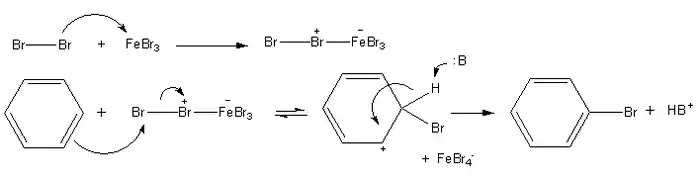
Mechanismus
Mechanismus chlorace a bromace benzenu je stejný:
Mechanismus jodace je mírně odlišný: jod reaguje s oxidačním činidlem, například s kyselinou dusičnou, za vzniku elektrofilního jodu (2 I+). Jod zde nepůsobí jako zásada, jelikož má kladný náboj. V jedné studii byla jako jodační činidlo použita směs jodu a kyseliny jodičné[1]
V dalších studiiích byla použita směs jodu a jodičnanu draselného v koncentrované kyselině sírové. Jako jodační činidlo zde působí trijodidový kation I3+ a jako zásada hydrogensíranový anion HSO4−. Zkoumaly se zde jak kinetika, tak i podmínky jodace silně deaktivovaných sloučenin jako jsou kyselina benzoová a 3-nitrobenzotrifluorid.[2][3]
První fáze halogenace aromatických sloučenin je jiná než u halogenace alkenů, protože u alkenů není ke zvýšení elektrofilnosti halogenu potřeba katalyzátor. Tvorba areniového iontu vede k dočasné ztrátě aromaticity. Jelikož má vznik areniového iontu vyšší aktivační energii ve srovnání s tvorbou haloniového iontu u alkenů, tak jsou areny méně reaktivní než alkeny a vyžadují oslabení vazeb mezi halogeny.
Přehled
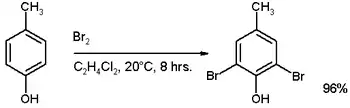
Pokud je na benzenové jádro navázán silně aktivující substituent jako například –OH, –OR nebo aminová skupina, tak není potřeba katalyzátor; příkladem může být bromace p-kresolu:[4]
Je-li ovšem použit katalyzátor při přebytku bromu, dojde k tvorbě tribromidu.
Halogenace fenolů probíhá díky disociaci fenolu rychleji v polárních rozpouštědlech, protože fenoxidové ionty jsou díky vyšší elektronové hustotě náchylnější k elektrofilnímu ataku.
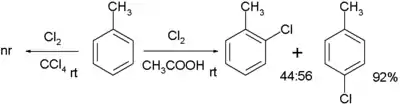
Chlorace toluenu bez použití katalyzátoru vyžaduje polární rozpouštědlo, například kyselinu octovou. Orto-para selektivita je nízká:[5]
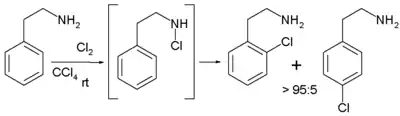
Reakce neprobíhá, pokud se jako rozpouštědlo použije tetrachlormethan. Pokud je reaktantem fenylethylamin, je možné použít poměrně nepolární rozpouštědla a dosáhnout výhradně orto regioselektivity, jelikož je následující reakční krok vnitromolekulární díky tvorbě meziproduktu z chloraminu.
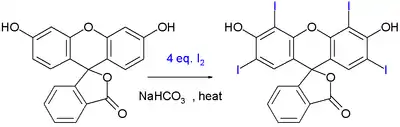
Potravinářské barvivo erythrosin lze připravit jodací jiného barviva fluoresceinu:
Reakce probíhá za přítomnosti hydrogenuhličitanu sodného.[6]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Elektrofilní halogenace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Elektrofilní halogenace na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Electrophilic halogenation na anglické Wikipedii.
- "Regioselective iodination of hydroxylated aromatic ketones" Bhagwan R. Patila, Sudhakar R. Bhusarec, Rajendra P. Pawara, and Yeshwant B. Vibhute b Arkivoc 2006 (i) 104–108. Online Article[nedostupný zdroj]
- "The kinetics of aromatic iodination by means of the tri-iodine cation", J. Arotsky, A. C. Darby and J. B. A. Hamilton, J. Chem. Soc. B, 1968, 739–742
- "Iodination and iodo-compounds Part IV", Judah Arotsky, A. Carl Darby and John B. A. Hamilton, J. Chem. Soc., Perkin Trans. 2, 1973, 595–599
- A. Sankaranarayanan; S. B. CHANDALIA. Process Development of the Synthesis of 3,4,5-Trimethoxytoluene. Organic Process Research & Development. 2006, s. 487–492. DOI 10.1021/op0502248. (anglicky)
- J. L. O'Connell; J. S. SIMPSON; P. G. DUMANSKI; G. W. SIMPSON; C. J. EASTON. Aromatic chlorination of ω-phenylalkylamines and ω-phenylalkylamides in carbon tetrachloride and α,α,α-trifluorotoluene. Organic and Biomolecular Chemistry. 2006, s. 2716–2723. DOI 10.1039/b605010g. PMID 16826296. (anglicky)
- "Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions" James V. McCullagh and Kelly A. Daggett Journal of Chemical Education 2007, 84, 1799. Abstract