Chlorid zinečnatý
Chlorid zinečnatý je anorganická sloučenina chloru a zinku (chemický vzorec ZnCl2). Existuje v devíti známých krystalových formách. Jedná se o bezbarvou nebo bílou látku dobře rozpustnou ve vodě. ZnCl2 je hygroskopický a navlhavý, proto musí být chráněn před vlhkostí, včetně vodních par ve vzduchu. Používá se v široké škále aplikací při zpracování textilu, jako tavidlo a v chemické syntéze.
| Chlorid zinečnatý | |
|---|---|
 | |
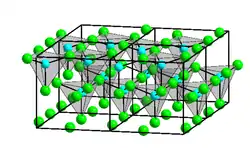
Krystalová struktura chloridu zinečnatého | |
| Obecné | |
| Systematický název | chlorid zinečnatý |
| Latinský název | Zinci chloridum |
| Anglický název | Zinc chloride |
| Německý název | Zinkchlorid |
| Sumární vzorec | ZnCl2 |
| Vzhled | bílý prášek nebo krystalky |
| Identifikace | |
| Registrační číslo CAS | 7646-85-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-592-0 |
| Indexové číslo | 030-003-00-2 |
| PubChem | 3007855 |
| UN kód | 2331 |
| Číslo RTECS | ZH1400000 |
| Vlastnosti | |
| Molární hmotnost | 136,315 g/mol |
| Teplota tání | 293 °C |
| Teplota varu | 732 °C |
| Hustota | 2,907 g/cm3 (20 °C) 2,905 g/cm3 (25 °C) |
| Index lomu | nDř= 1,687 nDm= 1,713 |
| Rozpustnost ve vodě | 342 g/100 g (0 °C) 396 g/100 g (20 °C) 408 g/100 g (25 °C) 437,15 g/100 g (30 °C) 453 g/100 g (40 °C) 468,02 g/100 g (50 °C) 488,78 g/100 g (60 °C) 542 g/100 g (80 °C) 613,54 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech |
methanol ethanol 100 g/100 g (12,5 °C) aceton 43,5 g/100 g (18 °C) roztok čpavku kapalný amoniak (ne) |
| Rozpustnost v nepolárních rozpouštědlech |
pyridin 2,6 g/100 g (20 °C) |
| Měrná magnetická susceptibilita | −5,6310−6 cm3g−1 |
| Povrchové napětí | 53,8 mN/m (320 °C) 53,6 mN/m (400 °C) 52,2 mN/m (700 °C) |
| Struktura | |
| Krystalová struktura | klencová |
| Hrana krystalové mřížky | a= 527 pm α= 91°30´ |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −415,1 kJ/mol |
| Entalpie tání ΔHt | 75,2 J/g |
| Entalpie varu ΔHv | 875 J/g |
| Entalpie rozpouštění ΔHrozp | −514 J/g |
| Standardní molární entropie S° | 111,5 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −369,5 kJ/mol |
| Izobarické měrné teplo cp | 0,523 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H314 H410 |
| R-věty | R22 R34 R50/53 |
| S-věty | (S1/2) S26 S36/37/39 S45 S60 S61 |
| NFPA 704 |  0
3
0
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Není znám žádný minerál s tímto chemickým složením, existuje však velmi vzácný nerost simonkolleit se vzorcem Zn5(OH)8Cl2·H2O.
Bezpečnost
Chlorid zinečnatý dráždí kůži a dýchací ústrojí.[2] Bezpečnostní opatření, která se vztahují k bezvodému ZnCl2, platí i pro jiné bezvodé halogenidy kovů, tj. jejich hydrolýza může být exotermická a je třeba se vyhýbat kontaktu s těmito látkami. Koncentrované roztoky jsou kyselé a žíravé, jakožto Lewisova kyselina poškozují celulózu a hedvábí.
Reference
V tomto článku byl použit překlad textu z článku Zinc chloride na anglické Wikipedii.
- Zinc chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Archivovaná kopie. www.jtbaker.com [online]. [cit. 2009-09-23]. Dostupné v archivu pořízeném dne 2009-01-05.
Literatura
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- G. J. McGarvey, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220–3, Wiley, New York, 1999.
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid zinečnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid zinečnatý na Wikimedia Commons - Grades and Applications of Zinc Chloride
- PubChem ZnCl2 summary.
- External MSDS Data Sheet Archivováno 1. 7. 2007 na Wayback Machine.


