Halonium
Halonium, též haloniový ion, je jakýkoliv ion, jehož součástí je atom halogenu s kladným nábojem. Obecný vzorec je R–X+–R, kde X je libovolný halogen a R je libovolná organická funkční skupina (může mít uzavřený i otevřený řetězec). Haloniové ionty odvozené postupně od fluoru, chloru, bromu a jodu se nazývají fluoronium, chloronium, bromonium a jodonium.
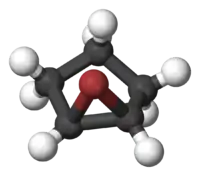
Struktura
Nejjednodušší haloniové ionty mají strukturní vzorec H–X+–H (X = F, Cl, Br, I); složitější často mají tříatomovou cyklickou strukturu podobnou epoxidům, která vzniká formální adicí halogeniového iontu X+ na dvojnou vazbu mezi uhlíky (C=C) v molekule alkenu.[1]
Reaktivita
Haloniové ionty jsou většinou jen krátce existujícími meziprodukty reakcí; díky tříčlennému cyklu a kladně nabitému atomu halogenu jsou značně reaktivní; kladný náboj jim dává silně elektrofilní vlastnosti. Téměř vždy jsou krátkou dobu po svém vzniku atakovány nukleofilem. I slabé nukleofily, jako je například voda, reagují s haloniovými ionty, čehož lze mimo jiné využít k přípravě halogenhydrinů.
Příležitostně se může halonium přesmykem změnit na karbokation; k této přeměně většinou dochází pouze tehdy, když je karbokation allylového nebo benzylového typu.[2]
Historie
Možnost existence haloniových kationtů poprvé naznačili Irving Roberts a George Elbert Kimball roku 1937[3] jako vysvětlení pozorované diastereoselektivity halogenových adičních reakcí u alkenů.Předpokládali, že úvodním reakčním meziproduktem při bromaci je −X–C–C+ a že rotací kolem jednoduché vazby by došlo ke vzniku vyrovnaných množství cis- a transizomerů, k čemuž zde nedocházelo. Také tvrdili, že kladně nabitý atom halogenu má elektronovou konfiguraci shodnou s kyslíkem a tak mají uhlík a brom srovnatelné ionizační potenciály.
V roce 1970 připravil a izoloval George Andrew Olah haloniové soli[4] přidáním methylhalogenidů, jako například brommethanu a chlormethanu v oxidu siřičitém při −78 °C ke komplexu fluoridu antimoničného a tetrafluormethanu, rovněž přítomných v prostředí oxidu siřičitého. Po odpaření SO2 se vytvořily krystaly CH3–X+–CH3SbF -
6 , které byly při pokojové teplotě stabilní, avšak při styku se vzdušnou vlhkostí se rozkládaly. V roce 2018 byl popsán fluoroniový ion v roztoku (v oxidu siřičitém nebo sulfurylchloridfluoridu) za nízké teploty.[5].
Byla popsána struktura cyklických a acyklických chloroniových,[6] bromoniových a jodoniových iontů, například adamantylidenadamantanbromonia.[7]
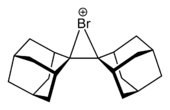 | 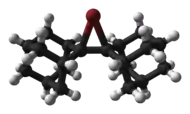 |
Sloučeniny s trojvaznými a čtyřvaznými haloniovými kationty neexistují, ovšem u některých z nich byla předpovězena stabilita pomocí metod výpočetní chemie.
Reference
V tomto článku byl použit překlad textu z článku Halonium ion na anglické Wikipedii.
- IUPAC Gold Book
- Bruice, Paula Yurkanis. Organic Chemistry, 7th Edition. Pearson Education, 2014. ISBN 0-321-80322-1
- Irving Roberts; GEORGE E. KIMBALL. The Halogenation of Ethylenes. Journal of the American Chemical Society. 1937, s. 947. DOI 10.1021/ja01284a507. (anglicky)
- George Andrew Olah, John R. DeMember. Friedel-Crafts chemistry. V. Isolation, carbon-13 nuclear magnetic resonance, and laser Raman spectroscopic study of dimethylhalonium fluoroantimonates. Journal of the American Chemical Society. 1970, s. 718. DOI 10.1021/ja00706a058. (anglicky)
- Spectroscopic Characterization of a [C–F–C]+ fluoronium ion in solution. Angewandte Chemie. 2018. DOI 10.1002/ange.201712021. (anglicky)
- T. Mori; R. RATHORE. X-Ray structure of bridged 2,2′-bi(adamant-2-ylidene) chloronium cation and comparison of its reactivity with a singly bonded chloroarenium cation. ChemComm. 1998, s. 927–928. DOI 10.1039/a709063c. (anglicky)
- R. S. Brown; R. W. NAGORSKI; A. J. BENNET; R. E. D. MCCLUNG; G. H. M. AARTS; M. KLOBUKOWSKI; R. MCDONALD. Stable Bromonium and Iodonium Ions of the Hindered Olefins Adamantylideneadamantane and Bicyclo[3.3.1]nonylidenebicyclo[3.3.1]nonane. X-Ray Structure, Transfer of Positive Halogens to Acceptor Olefins, and ab Initio Studies. J. Am. Chem. Soc.. March 1994, s. 2448–2456. DOI 10.1021/ja00085a027. (anglicky)