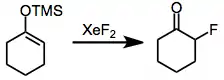
Elektrofilní fluorace
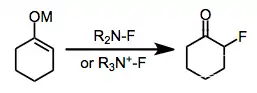
Elektrofilní fluorace je chemická reakce nukleofilu s uhlíkatým centrem a elektrofilního zdroje fluoru za vzniku organofluoridu. Pro tuto reakci lze použít elementární fluor i reaktanty obsahující vazby kyslík-fluor, ovšem nejčastěji se používají sloučeniny s vazbami dusík-fluor.[1]
Elektrofilní fluorace mohou být alternativou k nukleofilním fluoracím využívajícím fluoridy alkalických kovů nebo fluorid amonný či fluoridy síry. Vývoj reaktantů pro elektrofilní fluorace se převážně zaměřuje na snižování elektronové hustoty na atomu připojenému k fluoru; jako nejekonomičtější, nejstabilnější a nejbezpečnější reaktanty se ukázaly sloučeniny s vazbami dusík-fluor. Elektrofilní N-F reaktanty mohou být neutrální nebo kationtové a obsahovat sp2- i sp3-hybridizované dusíky. I když přesný mechanismus elektrofilní fluorace není znám, tak jsou popsány metody s vysokou účinností i stereoselektivitou.
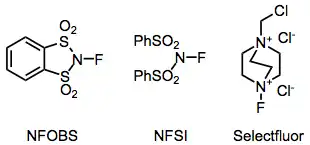
K nejčastějším fluoračním činidlům v organické syntéze patří N-fluor-o-benzendisulfonimid (NFOBS), N-fluorbenzensulfonimid (NFSI) a selectfluor.[1]
Mechanismus a stereochemie
Převažující mechanismus
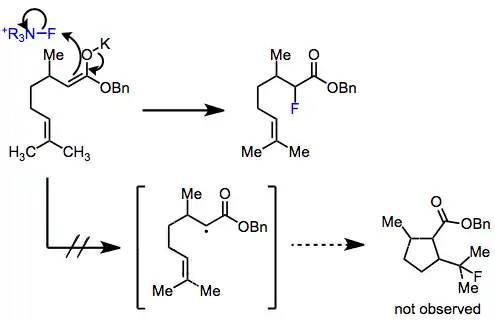
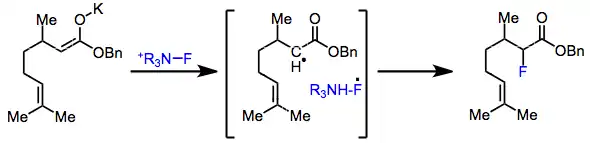
Mechanismus elektrofilní fluorace není znám, vedou se spory, zda reakce probíhá SN2 mechanismem nebo přes jednoelektronový přesun. Ve prospěch SN2 mechanismu je skutečnost, že arylovaná Grignardova činidla a organolithné sloučeniny mají při reakcích s N-fluor-o-benzendisulfonimidem za vzniku fluorbenzenu podobné výtěžnosti, i když jsou jejich reaktivity při jednoelektronových přesunech značně odlišné.[2] Při experimentech s 5-hexenyl- a cyklopropylenolethery se navíc netvořily žádné produkty přesmyků.[3] V kinetických studiích elektrofilních fluorací 1,3-dikarbonylových sloučenin různými N-F činidly se prostřednictvím Eyringova vzorce a Hammettovy rovnice ukázalo, že SN2 mechanismus je pravděpodobnější.[4]
Poločasy radikálů vznikajících při jednoelektronových přesunech jsou pravděpodobně o čtyři řády kratší než jsou meze detekce nejcitlivějších radikálových sond. Předpokládá se, že ihned po přesunu elektronů dochází k rekombinaci fluorových radikálů s alkylovými radikály.[5]
Stereoselektivní radikálové fluorace
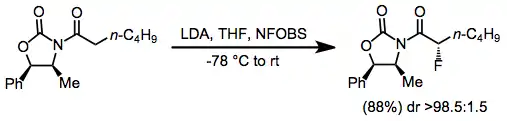
Stereoselektivita fluoračních reakcí se dělí na diastereoselektivitu a enantioselektivitu. Při diastereoselektivních metodách se používají chirální pomocníci navázaní na nukleofilní substrát. U fluorací karbonylových sloučenin lze dobrých výsledků dosáhnout například pomocí chirálních oxazolidinonů.[6]
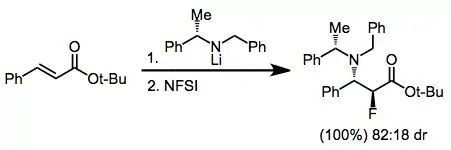
K přípravě chirálních β-amino-α-fluoresterů lze použít tandemovou konjugovanou adici s využitím chirálních nukleofilů.
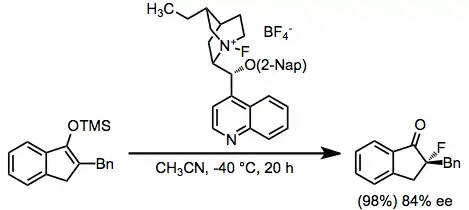
Enantioselektivní metody spočívají v použití stechiometrických množství chirálních fluoračních činidel; příkladem takových reaktantů jsou N-fluoramonné soli cinchonových alkaloidů. Tyto látky lze snadno připravit ze Selectfluoru a podobných alkaloidů.[7]
Možnosti a omezení
Fluorační činidla
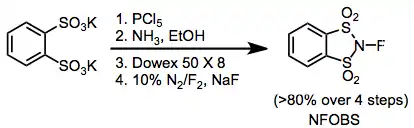
Elektrofilní N-F fluorační činidla mají skupiny odtahující elektrony navázané na dusíky, čímž se snižuje elektronová hustota na fluoru. N-fluorsulfonamidy jsou poměrně slabými fluoračními činidly, ovšem N-fluorsulfonimidy, například N-fluorbenzensulfonimid (NFSI), jsou velmi účinné a často používané. N-fluor-o-benzendisulfonimid (NFOBS) se připravuje z kyseliny disulfonové.[2]
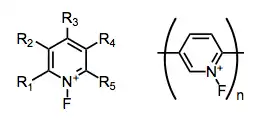
Při použití solí dusíkatých kationtů dochází k navýšení rychlostí a výtěžností elektrofilních fluorací díky tomu, že kationtový dusík snižuje elektronovou hustotu na fluoru. Jako elektrofilní fluorační činidla lze rovněž využít N-fluorpyridiniové a iminiové ionty. Protiionty těchto solí, i když nejsou přímo zapojené do přenosu fluoru na substrát, mají vliv na reaktivitu a mohou být upravovány několika různými metodami.[8]
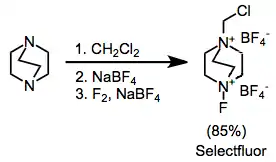
Nejlépe synteticky využitelné amonné soli jsou odvozeny od substituovaných DABCO-bis(amonných) iontů, takovým reaktantem je například Selectfluor.[9] Dají se snadno připravit alkylací a následnou fluorací. Difluorové varianty, které se zdály být lépe využitelné, poskytují pouze jeden atom fluoru.
Existují také specializovaná elektrofilní fluorační činidla, jako jsou neutrální heterocykly obsahující vazby N–F;[10] používají se k fluoracím určitých užších skupin substrátů.
Nukleofilní substráty
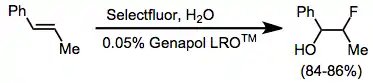
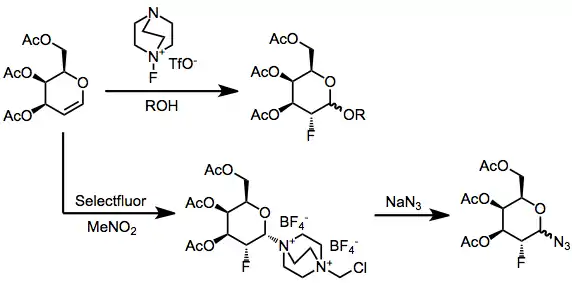
Při jednoduchých fluoracích alkenů často vznikají směsi mnoha produktů. Kofluorace za přítomnosti nukleofilu však vytváří výhradně vicinální alkoxyfluoridy.[11] Alkyny nelze fluorovat pomocí N-F činidel. Za účelem usnadnění kontaktu mezi Selectfluorem a alkenem se do reakční směsi přidávají aniontové tenzidy.
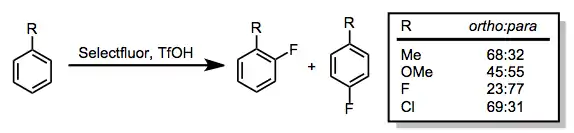
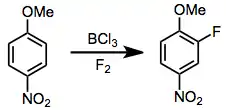
Fluorací sloučenin s vysokou elektronovou hustotou se tvoří arylfluoridy. Nejčastějšími potížemi při těchto reakcích jsou nízká ortho/para selektivita a (obzvláště u fenolů) dearomatizace.[12]
Enolethery a glykaly jsou dostatečně silnými nukleofily na to, aby mohly být fluorovány Selectfluorem.[13] Podobně jako u ostatních alkenů zde lze dosáhnout kohalogenace jak izolací meziproduktu, tak i reakcí s nukleofilem či přímým odstraněním DABCO in situ. Enoly je možné fluorovat enantioselektivně (viz výše) za přítomnosti chirálního fluoračního činidla.
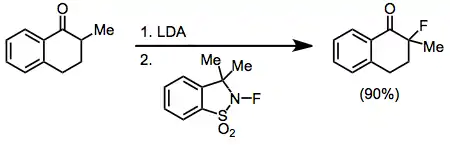
Enoláty kovů lze použít s velkým počtem fluoračních činidle, jako jsou NFSI, NFOBS a sulfonamidy. Nejlepší výtěžnosti monofluorovaných karbonylových sloučenin při reakcích s lithnými enoláty se obvykle dosahuje při použití 2-fluor-3,3-dimethyl-2,3-dihydrobenzo[d]isothiazol-1,1-dioxidu. U ostatních enolátů se tvoří mnoho difluorovaných produktů.[14]
Srovnání s jinými metodami
Přestože je použití molekulárního fluoru jako elektrofilního zdroje fluoru často nejlevnějším a nejpřímějším postupem, tak F2 často tvoří radikály a reaguje s vazbami C-H neselektivně. K omezení tvorby radikálů jsou nutné zdroje protonů nebo Lewisovy kyseliny, a i za jejich přítomnosti se jen u některých substrátů dosahuje vysoké selektivity.[15] Ke skladování plynného F2 je navíc nutné nákladné vybavení.
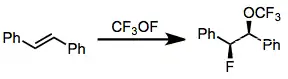
Reaktanty obsahující vazby O-F, například CF3OF, bývají selektivnější vzhledem k monofluoracím než N-F reaktanty.[16] Nepoužívají se ovšem tak často, protože se obtížně skladují a jsou značně oxidující.
Jako selektivní monofluorační činidlo může sloužit fluorid xenonatý, xenoničitý nebo xenonový. Nestabilita a vysoká cena těchto sloučenin však způsobuje, že se využívají méně než dusíkatá fluorační činidla.[17]
Reakční podmínky
I když se při fluoracích pomocí N-F činidel nevyužívá přímo molekulární fluor, tak se téměř vždy F2 používá při přípravě reaktantů. Ke správnému skladování F2 je potřeba opatrnost a zvláštní vybavení.[18] Používají se reakční nádoby z polytetrafluorethylenu (PTFE), které jsou u reakcí s využitím molekulárního fluoru vhodnější než nádoby z nerezové oceli nebo skla. Jsou dostupné směsi F2 s N2 či He, které umožňují řídit spotřebu fluoru. Teplota by měla být nízká a přísun fluoru pomalý, aby nedocházelo k radikálovým reakcím.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Electrophilic fluorination na anglické Wikipedii.
- Badoux, J.; Cahard, D. Org. React. 2007, 69, 347. DOI:10.1002/0471264180.or069.02
- Davis, F. A.; Han, W.; Murphy, C. K. J. Org. Chem. 1995, 60, 4730
- Differding, E.; Rüegg, G. M. Tetrahedron Lett. 1991, 32, 3815.
- Neshat Rozatian; Ian W. Ashworth; Graham Sandford; David R. W. Hodgson. A quantitative reactivity scale for electrophilic fluorinating reagents. Chemical Science. 2018, s. 8692–8702. DOI 10.1039/C8SC03596B.
- Piana, S.; Devillers, I.; Togni, A.; Rothlisberger, U. Angew. Chem. Int. Ed. Engl. 2002, 41, 979.
- Davis, F. A.; Kasu, P. V. N. Tetrahedron Lett. 1998, 39, 6135.
- Shibata, N.; Suzuki, E.; Asahi, T.; Shiro, M. J. Am. Chem. Soc. 2001, 123, 7001.
- Umemoto, T.; Harasawa, K.; Tomizawa, G.; Kawada, K.; Tomita, K. Bull. Chem. Soc. Jpn. 1991, 64, 1081.
- Stavber, S.; Zupan, M.; Poss, A. J.; Shia, G. A. Tetrahedron Lett. 1995, 36, 6769.
- Laali, K. K.; Tanaka, M.; Forohar, F.; Cheng, M.; Fetzer, J. C. J. Fluorine Chem. 1998, 91, 185.
- Lal, G. S. J. Org. Chem. 1993, 58, 2791.
- Zupan, M.; Iskra, J.; Stavber, S. Bull. Chem. Soc. Jpn. 1995, 68, 1655.
- Albert, M.; Dax, K.; Ortner, J. Tetrahedron 1998, 54, 4839
- Differding, E.; Lang, R. W. Helv. Chim. Acta. 1989, 72, 1248.
- Chambers, R. D.; Hutchinson, J.; Sandford, G. J. Fluorine Chem. 1999, 100, 63
- Rozen, S. Chem. Rev. 1996, 96, 1717
- Ramsden, C. A.; Smith, R. G. J. Am. Chem. Soc. 1998, 120, 6842.
- Umemoto, T.; Nagayoshi, M. Bull. Chem. Soc. Jpn. 1996, 69, 2287
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Elektrofilní fluorace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Elektrofilní fluorace na Wikimedia Commons