Aryny
Aryny, také nazývané benzyny, jsou reaktivní molekuly odvozené od molekul aromatických sloučenin odstraněním dvou substituentů. Nejčastěji se objevují ortho-aryny, mohou však také vznikat meta- a para-aryny.[1] Aryny patří mezi cykloalkyny.
Vazby u o-arynů
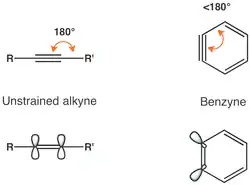
o-Aryny, neboli 1,2-didehydroareny, mají, jako i ostatní cykloalkyny s menšími cykly, vysoké vnitřní napětí.[2]
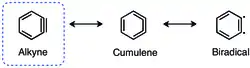
Toto napětí vede ke snížení překryvu p orbitalů a tedy k oslabení trojné vazby.[3] Frekvence vibrací trojné vazby v benzynu odpovídá vlnočtu 1846 cm−1,[4] což naznačuje, že je trojná vazba slabší než by byla za nepřítomnosti vnitřního napětí. Ortho-benzyn je ovšem spíše cyklickým alkynem než biradikálem, což vyplývá z velkého rozdílu energií mezi singletovým a tripletovým stavem a reaktivity odpovídající alkynu.
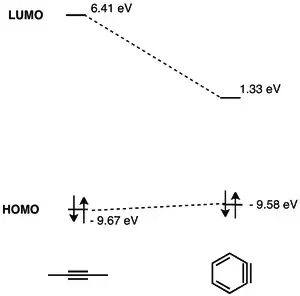
LUMO arynu má mnohem nižší energii než LUMO alkynu, u kterého není silné vnitřní napětí, díky čemuž lépe interaguje s HOMO nukleofilů. Benzyn je díky tomu elektrofilem a dobře reaguje s nukleofily.[5] Podrobná analýza MO benzynu byla publikována v roce 1968.[6]
Vznik o-arynů
Vzhledem ke své vysoké reaktivitě musejí být aryny připravovány těsně před využitím. Je také třeba zabránit jeho dimerizaci.
Prvním známým způsobem přípravy byla dehydrohalogenace arylhalogenidů:

Tyto reakce probíhají při vysokých teplotách a za přítomnosti zásad. Ortho-disubstituované areny lze však použít i za mírnějších podmínek.
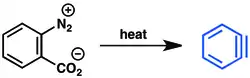
Další možností je dehalogenace 2-bromfluorbenzenu pomocí hořčíku.[7] Kyselina anthranilová může být pomocí diazotace následované neutralizací přeměněna na 2-diazoniobenzen-1-karboxylát. Tato zwitteriontová látka je výbušná,[8] ale přesto je vhodným prekurzorem benzynu.[9]
Jako výchozí látky lze také použít trimethylsilylaryltrifláty.[10] Odštěpení fluoridu z trifluormethylsulfonové akupiny vede k eliminaci triflátu a vzniku benzynu:
Pomocí hexadehydro Dielsovy–Alderovy reakce (cykloadiční reakce 1,3-diynu s alkynem) lze také získat benzyn.[11]

N-aminací 1H-benzotriazolu kyselinou hydroxylamin-O-sulfonovou vzniká produkt, který lze octanem olovičitým oxidovat na benzyn s téměř 100% výtěžností.[12]

Reakce o-arynů
Aryny jsou značně reaktivní i při nízkých teplotách. Jejich reaktivitu lze rozdělit do tří hlavních skupin: nukleofilní adice, pericyklické reakce a vložení vazby.
Nukleofilní adice na aryny
Za přítomnosti zásaditých nukleofilů se arylhalogenidy deprotonují v pozici alfa vzhledem k odcházející skupině, což vede k dehydrohalogenaci.Výsledky studií na základě výměny izotopů naznačují, že u arylfluoridů, a někdy i arylchloridů, probíhá eliminace ve dvou krocích, po deprotonaci dochází k odstranění nukleofilu; proces je tak podobný E1cb mechanismu u alifatických sloučenin. U bromarenů a jodarenů místo toho eliminace probíhá soustředěným synkoplanárním mechanismem.[13][14] Vzniklý benzyn vytváří adiční produkty, často nukleofilní adicí a následnou protonací. Tvorba benzynového meziproduktu je nejpomalejším krokem reakce.[15]
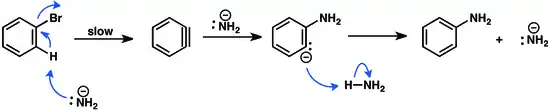
Pomocí „arynových párovacích reakcí“ se připravují bifenylové sloučeniny, používané při výrobě léčiv, v zemědělství a jako ligandy v řadě reakcí katalyzovaných kovy.[16]
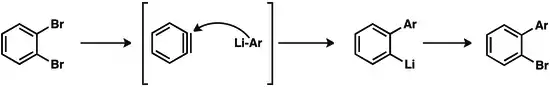
Sloučeniny arenů s kovy mohou reagovat s dalšími aryny, což vede k řetězcové polymerizaci. Při použití kyanidu měďného jako iniciátoru adice prvního arynu mohou vznikat polymery obsahující kolem 100 arenových jednotek.[17]
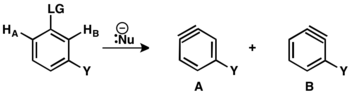
Když jsou odcházející skupina a substituent vůči sobě v poloze ortho nebo para, tak může vzniknout pouze jeden benzynový meziprodukt. Jsou-li v poloze meta, pak se mohou vytvořit dva různé produkty (A a B). Jestliže je substituentem skupina odtahující elektrony, tak HB je kyselejší než HA, což vede ke vzniku regioizomeru B. V případě, kdy je substituentem skupina dodávající elektrony, naopak vzniká regioizomer A, který má v tomto případě kyselejší proton.
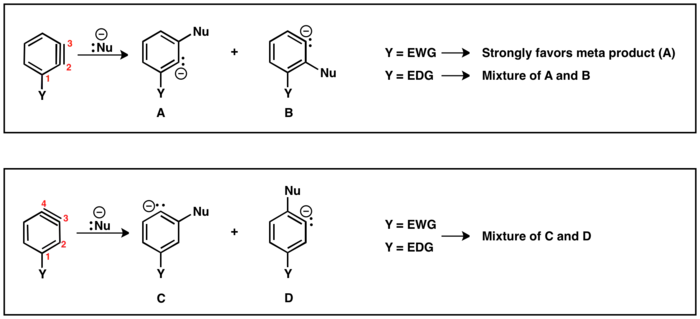
Možné regioizomery jsou dva: trojná vazba může být mezi druhým (C2) a třetím uhlíkem (C3) nebo mezi C3 a C4. Substituenty v poloze ortho vůči odcházející skupině vytvoří trojnou vazbu mezi C2 a C3, zatímco substituenty v poloze para vyztvoří produkt s trojnou vazbou mezi C3 a C4. Z meta substituentů mohou vzniknout oba regioizomery.
Jestliže se trojná vazba nachází mezi C2 a C3, tak substituenty odtahující elektrony, jako je trifluormethyl (CF3), budou řídit nukleofilní adici tak, aby proběhla co nejblíže k substituentu. Naproti tomu substituenty dodávající elektrony, například methyl (CH3), budou vyvolávat jen velmi nízkou selektivitu produktů. V případech, kdy je trojná vazba mezi C3 a C4, je vliv substituentu na regioselektivitu minimální a často tak vznikají směsi obou možných produktů.[15]
Pericyklické reakce arynů
U benzynů probíhá rychlá dimerizace za vzniku bifenylenů. V některých případech tato reakce probíhá obzvlášť rychle a s velmi vysokou výtěžností.[9][12] Trimerizací se tvoří trifenyleny.[18]
Benzyny mohou podstoupit [4+2] cyklizace. Pokud reakce probíhá za přítomnosti antracenu, je produktem tryptycen.[7] Níže je znázorněn soustředěný mechanismus Dielsovy–Alderovy reakce benzynu s furanem. Jiné [4+2] cyklizační reakce arynů mohou probíhat postupným mechanismem.

Příkladem cyklizační reakce arynu může být příprava 1,2,3,4-tetrafenylnaftalenu.[19] 1,2,4,5-Tetrabrombenzen může reagovat s n-butyllithiem za tvorby tetrahydroanthracenu.[20]
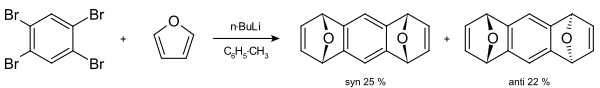
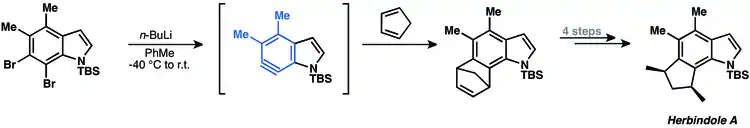
[4+2] cykloadice arynů se často využívají při totálních syntézách přírodních látek. Hlavním omezením těchto postupů je nutnost použití dienů s menšími cykly, jako jsou furan a cyklopentadien.[10] V roce 2009 byl takovýmto způsobem připraven herbindol A.[21] 6,7-indolyn reaguje s cyklopentadienem za vzniku tetracyklického produktu.
Aryny také reagují s alkeny v [2+2] cykloadicích. Protože jsou benzyny elektrofily, tak jsou k takovým reakcím nejvhodnější alkeny se substituenty dodávajícími elektrony.[22]
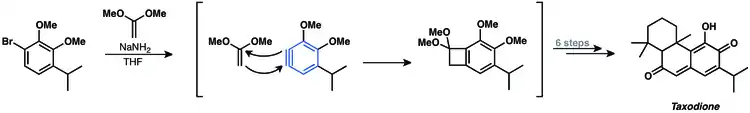
Vzhledem k tvorbě významných množství vedlejších produktů se arynové [2+2] cykloadice málokdy používají při přípravách přírodních látek, existují ovšem i takovéto případy. V roce 1982 byla popsána syntéza taxodionu s využitím [2+2] cykloadice arynu s acetalem ketenu.[23]
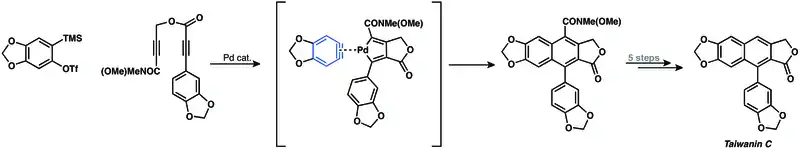
Také je možné provést palladiem katalyzovanou [2+2+2] kocykloadici arynu a diynu při syntéze taiwaninu C.[24]
Připojení vazby na molekuly arynů
První případ reakce arynu vedoucí k připojení vazby sigma na molekulu byla příprava melleinu popsaná v roce 1973.[25]
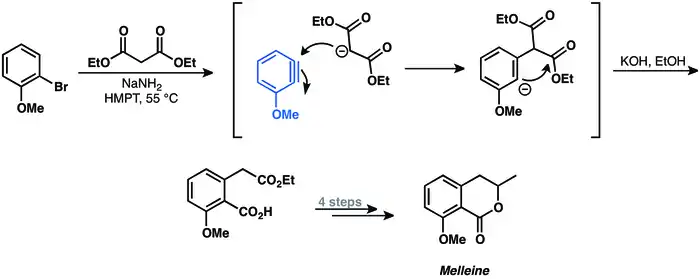
Další dehydrobenzeny
Kromě 1,2-didehydrobenzenu (benzynu) existují také dva další izomery: 1,3-didehydrobenzen a 1,4-didehydrobenzen.[1] Pomocí výpočetní chemie bylo zjištěno, že jejich energie jsou 444, 510 a 577 kJ/mol.[26]
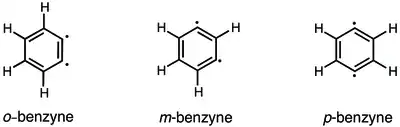
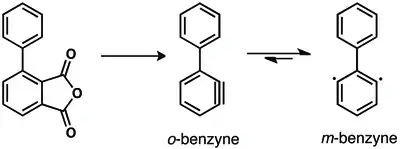
Byly zkoumány vzájemné přeměny 1,2-, 1,3- a 1,4-didehydrobenzenu.[26][27] Přeměna 1,2-didehydrobenzenu na 1,3-didehydrobenzen by měla probíhat při pyrolýze (za teploty 900 °C) fenylovaných prekurzorů arynů.[26] K přeměně jednoho arynu v jiný jsou potřeba velmi vysoké teploty.
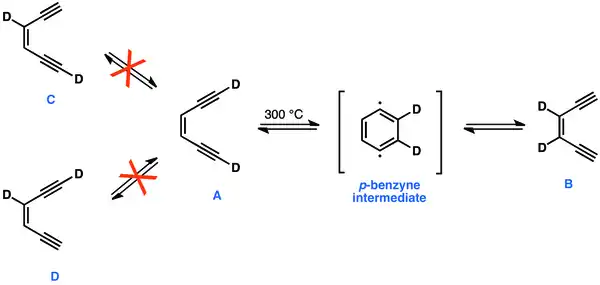
1,4-didehydroareny
Při pokusech o přípravu 1,4-didehydrobenzenu, prováděných při teplotách okolo 300 °C, docházelo k vytvoření rovnováhy [1,6-D2]-As [3,2-D2]-B, ovšem nikoliv s C a D. Přesun atomů deuteria na B a skutečnost, že nedošlo ke vzniku C nebo D, lze vysvětlit pouze přítomností cyklického a symetrického meziproduktu–1,4-didehydrobenzenu.[28]
1,4-didehydrobenzen se může vyskytovat ve dvou stavech: singletovém a tripletovém, přičemž singletový má nižší energii.[29][30] Tripletový stav má dvě neinteragující radikálová centra, a tak může odštěpovat vodíky stejně dobře jako fenylový radikál. Singletový stav je však stabilnější, při tvorbě přechodného stavu při odštěpení vodíku tak dochází k určité ztrátě energie, zde tak takováto reakce probíhá pomaleji.
Využití při syntéze přírodních látek
Mnoho přírodních látek se připravuje s využitím arenových meziproduktů.[10] Nukleofilní adice na aryny mají využití při úplných syntézách přírodních látek a jsou také jedněmi z nejstarších známých způsobu použití arynů.[10] Příklady látek syntetizovaných přes arynové meziprodukty jsou kryptaustolin (1) a kryptowolin (2).[31]
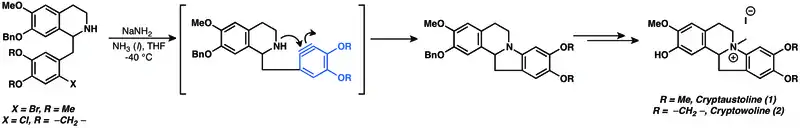
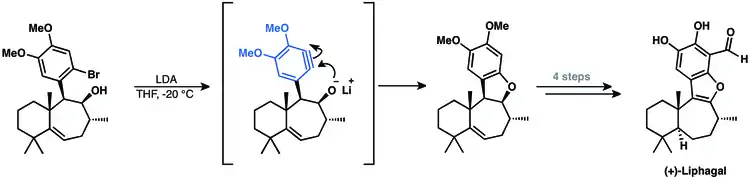
Při přípravě tetracyklického meroterpenoidu (+)-lifagalu také vzniká aryn.[32] Součástí je cyklizace vytvářející aryn, čímž vzniká poslední cyklická jednotka molekuly.[10]
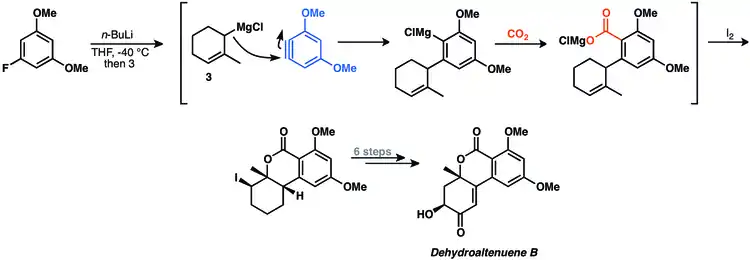
Vícesložkovými reakcemi arenů lze účinně a rychle připravovat 1,2-disubsituované areny. Při syntézách přírodních látek se však využívají jen ojediněle.[10] Při syntéze dehydroaltenuenu B se využívá čtyřsložková párovací reakce arynu.[33]
Reference
V tomto článku byl použit překlad textu z článku Aryne na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu Aryny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Aryny na Wikimedia Commons
- Hans Henning Wenk; Michael Winkler; Wolfram Sander. One Century of Aryne Chemistry. Angewandte Chemie International Edition. 2003, s. 502–528. DOI 10.1002/anie.200390151. PMID 12569480.
- Anslyn, E. V.; Dougherty, D. A.: Modern Physical Organic Chemistry, University Science Books, 2006, p612.
- C. M. Gampe; E. M. Carreira. Arynes and Cyclohexyne in Natural Product Synthesis. Angewandte Chemie International Edition in English. 2012, s. 3766–3768. DOI 10.1002/anie.201107485. PMID 22422638.
- J. G. Radziszewski; B. A. Hess Jr.; R. Zahradnik. Infrared Spectrum of o-Benzyne: Experiment and Theory. Journal of the American Chemical Society. 1992, s. 52. DOI 10.1021/ja00027a007.
- Gilchrist, T. L. Supplement C: The Chemistry of Triple Bonded Functional Groups, Part 1. Patai, S.; Rappaport, Z. Eds., John Wiley & Sons, New York, 1983
- Hoffmann, R.; Imamura, A.;Hehre, W. J. J. Am. Chem. Soc. 1968, 90, 1499
- Georg Wittig. Triptycene. Organic Syntheses. 1959, s. 75. DOI 10.15227/orgsyn.039.0075.
- John M. Sullivan. Explosion during preparation of benzenediazonium-2-carboxylate hydrochloride. Journal of Chemical Education. 1971-06-01, s. 419. ISSN 0021-9584. DOI 10.1021/ed048p419.3.
- Francis M. Logullo; Arnold M. Seitz; Lester Friedman. Benzenediazonium-2-Carboxylate and Biphenylene (Benzenediazonium, o-carboxy-, hydroxide, inner salt). Organic Syntheses. 1968, s. 12. DOI 10.15227/orgsyn.048.0012.
- P. M. Tadross; B. M. Stoltz. A Comprehensive History of Arynes in Natural Product Total Synthesis. Chemical Reviews. 2012, s. 3550–3577. DOI 10.1021/cr200478h. PMID 22443517.
- Hoye, T. R.; Baire, B.; Niu, D.; Willoughby, P. H.; Woods, B. P. Nature, 2012, 490, 208
- C. D. Campbell; C. W. Rees. Reactive intermediates. Part I. Synthesis and oxidation of 1- and 2-aminobenzotriazole. Journal of the Chemical Society C. 1969, s. 742–747. DOI 10.1039/J39690000742.
- Manuel Panar. The Elimination-Addition Mechanism of Nucleophilic Aromatic Substitution. Pasadena, CA: California Institute of Technology (Ph.D. Thesis), 1961. DOI 10.1039/J39690000742. S. 4–5.
- Thomas H. Lowry; Kathleen Richardson Schueller. Mechanism and theory in organic chemistry. New York: Harper & Row, 1987. (3). Dostupné online. ISBN 0060440848. S. 643.
- Anslyn, E. V.; Dougherty, D. A. Modern Physical Organic Chemistry. University Science Books, 2006
- Diemer, V.; Begaut, M.; Leroux, F. R.; Colobert, F. Eur. J. Org. Chem. 2011, 341
- Yoshihide Mizukoshi; Koichiro Mikami; Masanobu Uchiyama. Aryne Polymerization Enabling Straightforward Synthesis of Elusive Poly(ortho-arylene)s. Journal of the American Chemical Society. 2015, s. 74–77. DOI 10.1021/ja5112207. PMID 25459083.
- HEANEY, H.; MILLAR, I. T. Triphenylene. Org. Synth.. 1960, s. 105. Dostupné online. (anglicky); Coll. Vol.. S. 1120. (anglicky)
- 1,2,3,4-Tetraphenylnaphthalene. Organic Syntheses. 1966, s. 107. DOI 10.15227/orgsyn.046.0107.
- Use of 1,2,4,5-Tetrabromobenzene as a 1,4-Nenzadiyne Equivalent: Anti- and Syn-1,4,5,8-tetrahydroanthracene 1,4:5,8-diepoxides. Organic Syntheses. 1998, s. 201. DOI 10.15227/orgsyn.075.0201.
- Buszek, K. R.; Brown, N.; Kuo, D. Organic Letters 2009, 11, 201
- Pellissier, H.; Santelli, M. Tetrahedron, 2003, 59, 701
- Stevens, R. V.; Bisacchi, G. S. J. Org, Chem. 1982, 47, 2396
- Sato, Y.; Tamura,T.; Mori, M. Angew. Chem. Int. Ed. 2004, 43, 2436
- Guyot, M.; Molho, D. Tetrahedron Letters 1973, 14, 3433
- A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Blake, M. E.; Bartlett, K. L.; Jones, M. Jr. J. Am. Chem. Soc. 2003, 125, 6485. DOI:10.1021/ja0213672
- A p-Benzyne to m-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Completion of the Benzyne Cascade, Polishchuk, A. L.; Bartlett, K. L.; Friedman, L. A.; Jones, M. Jr. J. Phys. Org. Chem. 2004, Volume 17, Issue 9 , Pages 798 - 806. DOI:10.1002/poc.797
- Richard R. Jones; Robert G. Bergman. p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure. J. Am. Chem. Soc.. 1972, roč. 94, čís. 2, s. 660–661. DOI 10.1021/ja00757a071.
- Clauberg, H.; Minsek, D. W.; Chen, P. J. Am. Chem. Soc. 1992, 114, 99.
- Blush, J. A.; Clauberg, H.; Kohn, D. W.; Minsek, D. W.; Zhang, X.; Chen, P. Acc. Chem. Res. 1992, 25, 385
- Kametani, T.; Ogasawara, K. J. J. Chem. Soc., C 1967, 2208
- Day, J. J.; McFadden, R. M.; Virgil, S. C.; Kolding, H.; Alleva, J. L.; Stoltz, B. M. Angew. Chem. Int. Ed. 2011, 50, 6814.
- D. Soorukram; T. Qu; A. G. M. Barrett. Four-Component Benzyne Coupling Reactions: A Concise Total Synthesis of Dehydroaltenuene B. Organic Letters. 2008, s. 3833–3835. DOI 10.1021/ol8015435. PMID 18672878.