Kyanid měďný
Kyanid měďný je anorganická sloučenina se vzorcem CuCN. Používá se jako katalyzátor, při pokování mědi, a při přípravě nitrilů.[2]
| Kyanid měďný | |
|---|---|
Struktura | |
| Obecné | |
| Systematický název | kyanid měďný |
| Funkční vzorec | CuCN |
| Sumární vzorec | CCuN |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 544-92-3 |
| EC-no (EINECS/ELINCS/NLP) | 208-883-6 |
| PubChem | 11009 |
| SMILES | [Cu+].[C-]#N |
| InChI | 1S/CN.Cu/c1-2;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 89,563 g/mol |
| Teplota tání | 474 °C (747 K)[1] |
| Teplota varu | rozkládá se[1] |
| Hustota | 2,92 g/cm3[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v kyselině chlorovodíkové a vodném roztoku kyanidu draselného nebo amoniaku, nerozpustný v ethanolu[1] |
| Tlak páry | 0,13 kPa (572 °C)[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H300 H310 H330 H400 H410[1] |
| P-věty | P260 P262 P264 P270 P271 P273 P280 P284 P301+310 P302+350 P304+340 P310 P320 P321 P322 P330 P361 P363 P391 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Struktura
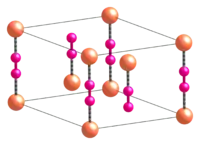
Kyanid měďný má polymerní strukturu. Vyskytuje se ve dvou polymorfních formách, které obě obsahují řetězce -[Cu-CN]- tvořené Cu centry propojené kyanidovými ligandy. Vysokoteplotní polymorf má strukturu podobnou kyanidu stříbrnému, lineární řetězec zaujímá tvar šestiúhelníku a sousední řetězce jsou posunuty o +/- 1/3 c.[3] U nízkoteplotního polymorfu řetězec není lineární a tvoří rozvlněné vrstvy, které se na sebe skládají, pootočené o 49°.[4]
.jpg.webp) Struktura vysokoteplotního polymorfu kyanidu měďného s řetězci rotujícíni kolem osy c; oranžová = měď, modrá = kyanidové ionty
Struktura vysokoteplotního polymorfu kyanidu měďného s řetězci rotujícíni kolem osy c; oranžová = měď, modrá = kyanidové ionty.jpg.webp) Struktura nízkoteplotního polymorfu kyanidu měďného; oranžová = měď, modrá = kyanidové ionty
Struktura nízkoteplotního polymorfu kyanidu měďného; oranžová = měď, modrá = kyanidové ionty
Nízkoteplotní polymorf lze přeměnit na vysokoteplotní zahřátím na 563 K (290 °C) v inertní atmosféře. U obou polymorfů mají vazby Cu-C délku 185 pm.[5]
Příprava
Kyanid měďný lze zakoupit jako nízkoteplotní polymorf. Připravuje se redukcí síranu měďnatého hydrogensiřičitanem sodným za teploty 60 °C a následné reakce produktu s kyanidem sodným.[6]
- 2 CuSO4 + NaHSO3 + H2O + 2 NaCN → 2 CuCN + 3 NaHSO4
Po přidání hydrogensiřičitanu sodného roztok síranu měďnatého změní barvu na zelenou a přidá se kyanid sodný. Reakce se provádí v mírně kyselém prostředí. V minulosti se kyanid měďný připravoval přímou reakcí síranu měďnatého s kyanidem sodným, kdy také vznikal dikyan:[7]
- 2 CuSO4 + 4 NaCN → 2 CuCN + (CN)2 + 2 Na2SO4
Tvorba dikyanu při této reakci způsobovala nedostatečnou čistotu takto připraveného kyanidu, a proto se tento postup v průmyslu nepoužívá.
Podobným způsobem lze připravit jodid měďný, čímž se projevují vlastnosti kyanidového aniontu odpovídající pseudohalogenidům, a lze tak také vysvětlit, proč nebyl připraven kyanid měďnatý.
Reakce
Kyanid měďný je ve vodě nerozpustný, avšak rozpouští se snadno v roztocích kyanidů za vzniku komplexů [Cu(CN)3]2− a [Cu(CN)4]3−, čímž se liší od kyanidu stříbrného a zlatného, které tvoří ionty [M(CN)2]−.[8]
Použití
Kyanid měďný se používá při pokovovávání mědi.[2]
Organická syntéza
CuCN reaguje s organolithnými sloučeninami za vzniku smíšených solí se vzorci Li[RCuCN] a Li2[R2CuCN]. Použitím CuCN došlo ke zjednodušení přípravy organoměďných činidel typu CuR a LiCuR2, nazývaných Gilmanova činidla.
Uvedené smíšené soli jsou zdroji karboaniontů, méně reaktivní než organolithné sloučeniny. Díky tomu je lze využít například v konjugovaných adicích.
Kyanid měďnatý může být také použit na přípravu stanylových a silylových sloučenin, používaných jako zdroje R3Sn− a R3Si−.[9]
Kyanid měďný se používá na přeměnu arylhalogenidů na nitrily.[10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Copper(I) cyanide na anglické Wikipedii.
- Copper(I) cyanide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- H. Wayne Richardson "Copper Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a07_567
- S. J. Hibble; S. M. Cheyne; A. C. Hannon; S. G. Eversfield. CuCN: A Polymorphic Matirial. Structure of One Form from Total Neutron Diffraction. Inorganic Chemistry. 2002, s. 8040–8048.
- S. J. Hibble; S. G. Eversfield; A. R. Cowley; A. M. Chippindale. Copper(I) Cyanide: A Simple Compound with a complicated Structure and Surprising Room-Temperature Reactivity. Angewandte Chemie International Edition. 2004, s. 628–630.
- S. Kroeker; R. E. Wasylishen; J. V. Hanna. The Structure of Solid Copper(I) Cyanide: A Multinuclear Magnetic and Quadrupole Resonance Study. Journal of the American Chemical Society. 1999, s. 1582–1590.
- H. J. Barber. Cuprous Cyanide: A Note on its Preparation and Use. Journal of the American Chemical Society. 1943, s. 79.
- J. V. SUPNIEWSKI AND P. L. SALZBERG. Allyl Cyanide. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 46. (anglicky)
- A. G. Sharpe. The Chemistry of Cyano Complexes of the Transition Metals. [s.l.]: Academic Press, 1976. ISBN 0-12-638450-9. S. 265.
- Dieter, R. K. In Modern Organocopper Chemistry; Krause, N., Ed.; Wiley-VCH: Mörlenback, Germany, 2002; Chapter 3.
- Steven H. Bertz, Edward H. Fairchild, Karl Dieter, "Copper(I) Cyanide" in Encyclopedia of Reagents for Organic Synthesis 2005, John Wiley & Sons. DOI:10.1002/047084289X.rc224.pub2
Externí odkazy
 Obrázky, zvuky či videa k tématu Kyanid měďný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Kyanid měďný na Wikimedia Commons - National Pollutant Inventory - Cyanide compounds fact sheet
- National Pollutant Inventory - Copper and compounds fact sheet

