Teória VSEPR
Teória VSEPR je chemická teória, ktorá umožňuje predpovedať tvar molekúl podľa počtu elektrónových párov, ktoré obklopujú centrálny atóm zlúčeniny.
VSEPR je skratka odvodená od angl. Valence shell electron pair repulsion čo by sa do slovenčiny dalo preložiť ako (teória) odpudzovania elektrónových párov valenčnej vrstvy. Zriedkavejšie sa dá stretnúť aj s jej alternatívnym názvom Gillespieho-Nyholmova teória. Tento názov pochádza z mien jej dvoch hlavných tvorcov - Ronalda Gillespieho a Ronalda Nyholma.
Teória VSEPR hovorí o tom, že valenčné elektróny sa kvôli ich rovnakému náboju navzájom odpudzujú a preto nadobudnú tvar pri ktorom je toto vzájomné odpudzovanie čo najmenšie, čím sa teda mení aj celkový tvar molekuly.
Teória VSEPR je na rozdiel od orbitálovej hybridizácie, ktorá je založená na vlnovej funkcii, založená na pozorovateľnej hustote elektrónov a preto, aj keď obidve teórie hovoria o tvare molekúl, nie sú navzájom prepojené.[1]
Určenie tvaru
VSEPR sa používa na určenie tvaru najmä jednoduchých a symetrických molekúl.
Počet elektrónových párov sa určuje po nakreslení elektrónového štruktúrneho vzorca
Metóda AXE
Pri teórii VSEPR sa na určovanie tvaru molekuly často používa tzv. „metóda AXE“. Presnejšie ide o zápis AXnEm, kde A je centrálny atóm (vždy 1), X sú jeho ligandy (atómy, ktoré sa naň viažu), n vyjadruje ich počet a E sú neväzbové elektrónové páry a m vyjadruje ich počet. Súčet Xn a Em nazývame stérické číslo - napríklad molekula zapísaná ako AX4E2 by mala stérické číslo 6.
Na základe stérického čísla, počtu ligandov a počtu neväzbových elektrónových párov sa dá podľa nasledujúcich tabuľiek predpokladať tvar molekuly.
| Stérické číslo | Tvar molekuly pri:[2] | |||
|---|---|---|---|---|
| 0 neväzbových elektrónových párov | 1 neväzbovom elektrónovom páre | 2 neväzbových elektrónových pároch | 3 neväzbových elektrónových pároch | |
| 2 | ||||
| 3 | 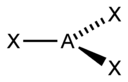 | 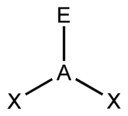 | ||
| 4 | 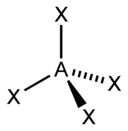 | 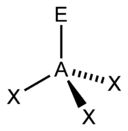 | 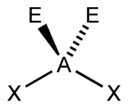 | |
| 5 | 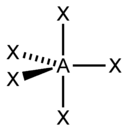 | 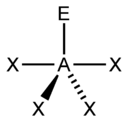 | 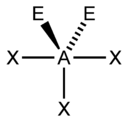 | 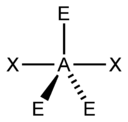 |
| 6 | 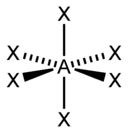 | 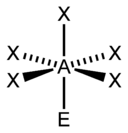 | 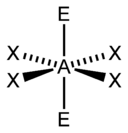 | |
| 7 | 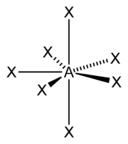 | 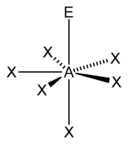 | 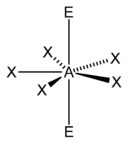 | |
| Druh molekuly podľa AXE | Tvar[2] | Štruktúra molekuly[2] | Príklady | |
|---|---|---|---|---|
| S neväzbovými elektrónovými pármi (žlté) | Bez neväzbových elektrónových párov | |||
| AX2E0 | Lineárny | BeCl2[3] , HgCl2[3], CO2 | ||
| AX2E1 | Lomený | 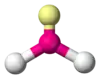 | 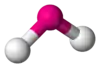 | NO2-[3], SO2[2], O3[3], CCl2 |
| AX2E2 | Lomený | 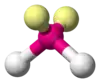 | 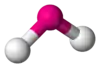 | H2O[2], OF2 |
| AX2E3 | Lineárny | 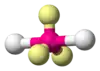 | XeF2[2], I3-, XeCl2 | |
| AX3E0 | Trojuholník | 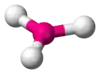 | 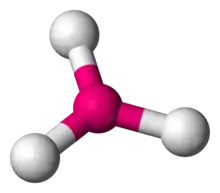 | BF3[2], CO32-, NO3-, SO3 |
| AX3E1 | Trigonálna pyramída |  | 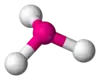 | NH3[2], PCl3 |
| AX3E2 | Tvar T | 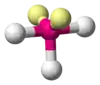 | 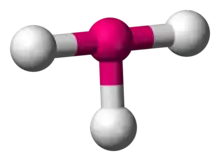 | ClF3[2], BrF3 |
| AX4E0 | Štvorsten | 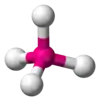 | 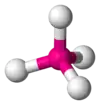 | CH4[2], PO43-, SO42-, ClO4-[3], XeO4 |
| AX4E1 | Deformovaný štvorsten |  | 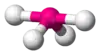 | SF4[2] |
| AX4E2 | Rovinný štvorec | 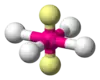 | 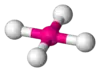 | XeF4[2] |
| AX5E0 | Trigonálna bipyramída | 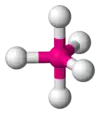 |  | PCl5[2] |
| AX5E1 | Tetragonálna pyramída | 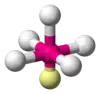 | 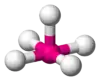 | ClF5, BrF5[2], XeOF4 |
| AX5E2 | Rovinný päťuholník | 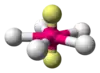 | 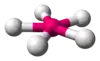 | XeF5- |
| AX6E0 | Osemsten | 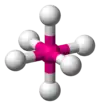 | 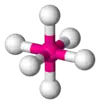 | SF6[2], WCl6 |
| AX6E1 | Pentagonálna pyramída |  | 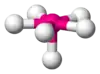 | XeOF5-, IOF5- |
| AX7E0 | Pentagonálna bipyramída | 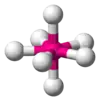 | 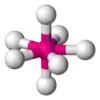 | IF7 |
Molekuly vymykajúce sa predpokladanému tvaru
Niektoré AX2E0 molekuly
Štruktúra v plynnej fáze trojatómových halogenidov kovov alkalických zemín (napríklad halogenidy vápnika, stroncia alebo bária; MX2) nemajú lineárny tvar ako sa dá podľa teórie VSEPR predpokladať, ale lomený. Podľa Ronalda Gillepsieho je to spôsobené interakciou medzi ligandmi a nevalenčnými elektrómni centrálneho atómu.[4]
Niektoré AX2E2 molekuly
Príkladom iného tvaru AX2E2 molekuly je oxid lítny (Li2O), ktorý aj keď by mal mať lomený tvar má lineárny. Toto sa dá vysvetliť kvôli iónovým väzbám v molekule, kvôli ktorým sa atómy lítia navzájom silno odpudzujú.[5] Ďalším príkladom je molekula H3Si-O-SiH3, kde je uhol medzi atómami kremíka a kyslíka 144,1 ° (pre porovnanie s ostatnými podobnými molekulami, Cl2O - 110,9 °; CH3-O-H3C - 111,7 °). Podľa Gillepsieho je uhol medzi týmito atómami práve taký kvôli vzájomnému odpudzovaniu relatívne veľkých -SiH3 ligandov. [6]
Niektoré AX6E1 molekuly
AX6E1 molekuly ako napríklad fluorid xenónový (XeF6) a štvormocné katióny telúru a trojmocné katióny bizmutu, ako napríklad TeCl62-, TeBr62-, BiCl63-, BiBr63-, BiI63- sú namiesto tvaru pentagonálnej pyramídy, predpokladaného teóriou VSEPR, v tvare osemstenu, pretože neväzbové elektrónové páry neovplyvňujú tvar molekuly v takej miere ako predpokladá teória VSEPR.[7]
Referencie
- GILLESPIE, Ronald J.. Teaching Molecular Geometry with the VSEPR Model [online]. 1. marca 2004, [cit. 2019-04-15]. Dostupné online. (po anglicky)
- PETRUCCI, R. H.. General Chemistry: Principles and Modern Applications. [s.l.] : [s.n.], 2002. ISBN 978-0-13-014329-7. (po anglicky)
- JOLLY, W. L.. Modern Inorganic Chemistry. [s.l.] : [s.n.], 1984. ISBN 978-0-07-032760-3. (po anglicky)
- GILLESPIE, Ronald J.; BYTHEWAY, Ian; BADER, Richard F. W.; TANG, Ting-Hua. Core Distortions and Geometries of the Difluorides and Dihydrides of Ca, Sr, and Ba [online]. apríl 1995, [cit. 2019-04-16]. Dostupné online. (po anglicky)
- A spectroscopic determination of the bond length of the LiOLi molecule: Strong ionic bonding (po anglicky)
- GILLESPIE, Ronald J.; ROBINSON, Edward A. Models of molecular geometry [online]. 11. apríl 2005, [cit. 2019-04-16]. Dostupné online. (po anglicky)
- WELLS, A. F.. Structural Inorganic Chemistry. 5. vyd. [s.l.] : Oxford Science Publications, 1984. ISBN 978-0-19-855370-0. (po anglicky)