Hybridizácia (chémia)
Hybridizácia alebo hybridizácia elektrónových dráh je kombinácia (kríženie) energeticky rozdielnych orbitálov s1, px1, py1 a pz1, pričom vznikajú energeticky rovnaké rovnocenné hybridné orbitály, ktoré môžu vytvárať rovnocenné väzby. Aby mohla hybridizácia vôbec nastať, je potrebné, aby atóm prešiel do excitovaného stavu, tj. aby sa v spomínaných orbitáloch nachádzali len nespárené elektróny. Keby elektróny kovov alkalických zemín spolu s berýliom a horčíkom neexcitovali a ich orbitály by sa nehybridovali, netvorili by žiadne zlúčeniny, z dôvodu, že ich valenčná elektrónová konfigurácia je všeobecne ns2. Teda nemajú v orbitále s žiadne nespárené elektróny, ktoré by tvorili väzby. Poznáme 3 základné typy hybridizácie: sp, sp2 a sp3.
Hybridizácia sp
Nastáva keď sa zhybridujú orbitály s1 a px1 a vzniknú dva sp-orbitály, ktoré sa usporiadajú tak, aby sa čo najmenej odpudzovali. Teda zvierajú uhol 180o. Takýto atóm môže tvoriť len dve σ-väzby. Ak má atóm k dispozícii aj navzájom kolmé nezhybridovanépy1 alebo aj pz1-orbitály, môže tvoriť jednu prípadne dve π-väzby (môže tvoriť dvojitú alebo trojitú väzbu). Všeobecne sa dá povedať, že môže nastať u atómov od II.A po IV.A skupinu.
Príklad sp hybridizácie
(Hrubo označené orbitály sa hybridujú a tvoria v molekule σ-väzby, prípadné nehybridované orbitály tvoria v molekule π-väzby)
- BeCl2
Valenčná elektrónová konfigurácia Be: 2s2
Excitovaná valenčná elektrónová konfigurácia Be: 2s1 2px1
- CH≡CH
Valenčná elektrónová konfigurácia C: 2s2 px1 py1
Excitovaná valenčná elektrónová konfigurácia C: 2s1 px1 py1 pz1
Hybridizácia sp2

Nastáva keď sa zhybridujú orbitály s1, px1 a py1 a vznikajú tri sp2-orbitály. Usporiadajú sa tak aby sa čo najmenej odpudzovali, teda zvierajú uhol 120o a smerujú do vrcholov rovnostranného trojuholníka. Takýto atóm môže tvoriť tri σ-väzby. A ak má atóm k dispozícii kolmý nezhybridovaný pz1-orbitál, môže tvoriť jednu π-väzbu (môže tvoriť dvojitú väzbu). Všeobecne sa dá povedať, že môže nastať u atómov od III.A po IV.A skupinu.
Príklad sp2 hybridizácie
(Hrubo označené orbitály sa hybridujú a tvoria v molekule σ-väzby, prípadné nehybridované orbitály tvoria v molekule π-väzby)
- BF3
Valenčná elektrónová konfigurácia B: 2s2 px1
Excitovaná válenčná elektrónová konfigurácia B: 2s1 px1 py1
- CH2=CH2
Valenčná elektrónová konfigurácia C: 2s2 px1 py1
Excitovaná valenčná elektrónová konfigurácia C: 2s1 px1 py1 pz1
Hybridizácia sp3
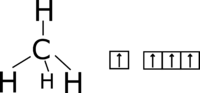
Nastáva keď sa zhybridujú orbitály s1, px1, py1 a pz1 a vznikajú štyri sp3-orbitály. Usporiadajú sa tak aby sa čo najmenej odpudzovali, zvierajú uhol 109°28' a smerujú do vrcholov pravidelného štvorstena. Takýto atóm môže tvoriť štyri σ-väzby. Keďže nemá p-orbitál s 1 nespáreným elektrónom, netvorí π-väzby. Všeobecne sa dá povedať, že môže nastať u atómov IV.A skupiny.
Príklad sp3 hybridizácie
(Hrubo označené orbitály sa hybridujú a tvoria v molekule σ-väzby)
- CH3-CH3
Valenčná elektrónová konfigurácia C: 2s2 px1 py1
Excitovaná valenčná elektrónová konfigurácia C: 2s1 px1 py1 pz1
| Chemický portál |