Chlorid fosforečný
Chlorid fosforečný je jeden z najdôležitejších chloridov fosforu, medzi ďalšie patria chlorid fosforitý a oxychlorid fosforečný. Jeho hlavne využitie je ako chloračné činidlo. Ide o bezfarebnú pevnú látku, komerčné produkty však bývajú nažltlé, pretože sú kontaminované chlorovodíkom.
| Chlorid fosforečný | |||||||||||||||||||||||||||||||||||||||
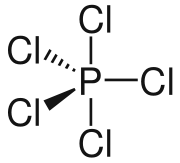 Chlorid fosforečný | |||||||||||||||||||||||||||||||||||||||
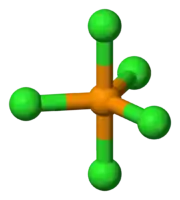 Chlorid fosforečný | |||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | PCl5 | ||||||||||||||||||||||||||||||||||||||
| Vzhľad | žltobiela kryštalická látka | ||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 208,2 u | ||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 208,239 g/mol | ||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 166,8 °C (za vyššieho tlaku) | ||||||||||||||||||||||||||||||||||||||
| Teplota sublimácie | 162 °C | ||||||||||||||||||||||||||||||||||||||
| Kritický bod | Teplota: 372 °C | ||||||||||||||||||||||||||||||||||||||
| Hustota | 2,114 g/cm³ (25 °C) 0,004 65 g/cm³ (296 °C, plyn) | ||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: rozkladá sa v nepolárnych rozpúšťadlách: tetrachlórmetán sírouhlík | ||||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Entropia sublimácie | 303,5 J/g | ||||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −398,9 kJ/mol (plyn) −463,5 kJ/mol (kvapalina) | ||||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 352,8 J K−1 mol−1 | ||||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −324,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 10026-13-8 | ||||||||||||||||||||||||||||||||||||||
| Číslo UN | 1806 | ||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 233-060-3 | ||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | TB6125000 | ||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||
Príprava
Chlorid fosforečný sa pripravuje chlórovaním chloridu fosforitého. Táto reakcia bola v roku 2000 použitá na výrobu cca 10 000 ton chloridu fosforečného. [1]
- PCl3 + Cl2 ⇌ PCl5 ΔH = -124 kJ/mol
Chlorid fosforečný existuje v rovnováhe s chloridom fosforitým a chlórom a pri 180 °C je stupeň disociácie cca 40%.[1] Kvôli tejto rovnováhe vzorky chloridu fosforečného často obsahujú chlór, ktorý spôsobuje zelenkasté sfarbenie.
Bezpečnosť
Chlorid fosforečný za normálneho tlaku pri teplote 162 °C sublimuje. Je nebezpečnou látkou, pretože búrlivo reaguje s vodou. Pri reakcii vzniká chlorovodík a chlór.
Podobné látky
- Bromid fosforečný
- Fluorid fosforečný
- Jodid fosforečný
- Chlorid fosforitý
- Oxychlorid fosforečný
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid fosforečný na českej Wikipédii.
Referencie
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Externé odkazy
- The period 3 chlorides (po anglicky)
- International Chemical Safety Card 0544 (po anglicky)






