Chlorid ortutný
Chlorid ortutný (Hg2Cl2) je anorganická zlúčenina chlóru a ortuti, v ktorej je oxidačné číslo ortuti I.
| Chlorid ortutný | |||||||||||||||||||||||||||||||||||||||
Chlorid ortutný | |||||||||||||||||||||||||||||||||||||||
 Chlorid ortutný | |||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | Hg2Cl2 | ||||||||||||||||||||||||||||||||||||||
| Synonymá | Kalomel Dichlorid diortutný | ||||||||||||||||||||||||||||||||||||||
| Vzhľad | Biela kryštalická alebo práškovitá látka | ||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 472,1 u | ||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 472,086 g/mol | ||||||||||||||||||||||||||||||||||||||
| Teplota sublimácie | 383 °C | ||||||||||||||||||||||||||||||||||||||
| Trojný bod | 525 °C | ||||||||||||||||||||||||||||||||||||||
| Hustota | 7,150 g/cm3 | ||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 0,2 mg/100 ml | ||||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | -265 kJ/mol | ||||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 196 J K−1 mol−1 | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 10112-91-1 | ||||||||||||||||||||||||||||||||||||||
| Číslo UN | 2025 | ||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 233-307-5 | ||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | OV8740000 | ||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||
Opis
Chlorid ortutný je hustá biela alebo žltkasto biela, pevná látka bez zápachu a vône. V prírode sa nachádza ako zriedkavý minerál kalomel. Chlorid ortutný býva súčasťou referenčnej elektródy v elektrochémii.
Vlastnosti
Ortuť je jedinečná pre svoju schopnosť, ľahko vytvárať väzby typu M-M. Chlorid ortutný je lineárna molekula. Minerál kalomel kryštalizuje v tetragonálnej štruktúre, s priestorovým usporiadaním I4/m 2/m 2/m. Elementárna bunka z kryštálovej štruktúry je uvedená nižšie:
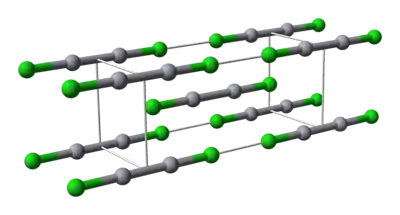 Model molekuly chloridu ortutného | 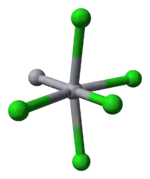 Model skreslenia oktaéderalnej koordinácie ortute v kalomeli |
Dĺžka väzby Hg-Hg je 253 pm (Hg-Hg v kove je 300 pm) a dĺžka väzby Hg-Cl v lineárnej štrutúre chloridu ortutného je 243 pm. Celková koordinácia každého atómu ortute je oktaéderalná, okrem dvoch najbližších susedných, sú tam štyri iné atómy chlóru s 321 pm. Existencia dlhších polykatiónov ortute, v chloride ortutnom, bola potvrdená.
Výroba a reakcie
Chlorid ortutný sa vyrába reakciou elementárnej ortute s chloridom ortutnatým:
- Hg + HgCI2 → Hg2Cl2
Môže byť pripravený, tiež pomocou vyzrážania, v metatéznej reakcii, obsahujúci vodný roztok dusičnanu ortutného, s použitím rôznych zdrojov chloridového aniónu, vrátane NaCl alebo HCl.
- 2 HCl + Hg2(NO3)2 → Hg2Cl2 + 2 HNO3
Amoniak reaguje s chloridom ortutným, disproporcionálne:
- Hg2Cl2 + 2 NH3 → Hg + Hg(NH2)Cl + NH4Cl
Kalomelová elektróda
Chlorid ortutný sa používa vo veľkej miere v elektrochémii, s využitím jednoduchosti jeho oxidačno-redukčných reakcií. Kalomelová elektróda býva referenčnou elektródou, a to najmä v starších publikáciách. Počas posledných 50 rokov, bola nahradená elektródou, striebro/chlorid strieborný (Ag/AgCl). Aj keď sa ortuťové elektródy sa prestali používať vo veľkej miere, kvôli nebezpečnej povahe ortute, mnohý chemici veria, že sú stále lepšie a že nie sú nebezpečné, ak sú používané správne. Rozdiely v experimentálnych potenciáloch sa líšia len minimálne od hodnôt uvádzaných v literatúre. Ostatné typy elektród sa môžu líšiť v závislosti na podmienkach, 70 až 100 milivoltov.
Fotochémia
Chlorid ortutný sa po vystavení UV žiareniu, rozloží na chlorid ortutnatý a elementárnu ortuť.
- Hg2Cl2 → HgCI2 + Hg
Proces tvorby ortute môže byť použitý pre výpočet počtu fotónov vo svetelnom zväzku, technikou aktinometrie. Využitím svetelnej reakcie v prítomnosti chloridu ortutnatého a šťavelanu amónneho, za vzniku chloridu ortutného, chloridu amónneho a oxidu uhličitého.
- 2 HgCl2 + (NH4)2C2O4 + Svetlo → Hg2Cl2(s) + 2 NH4Cl + 2 CO2
Táto konkrétna reakcia bola objavená J. M. Ederom (odtiaľ názov Ederová reakcia), v roku 1880 a opätovne overené, W. E. Rosevaereom v roku 1929
Podobné látky
- Bromid ortutný
- Fluorid ortutný
- Jodid ortutný
- Chlorid ortutnatý
Externé odkazy
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Mercury(I) chloride na anglickej Wikipédii.




