Wilkinsonův katalyzátor
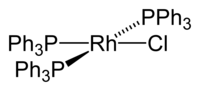
Wilkinsonův katalyzátor je běžně používaný název pro chloridotris(trifenylfosfan)rhodium, komplexní sloučeninu rhodia se vzorcem [RhCl(P(C6H5)3)3]. Jedná se o hnědočervený prášek rozpustný v uhlovodících a ještě lépe v tetrahydrofuranu a chlorovaných rozpouštědlech jako je dichlormethan. Používá se jako katalyzátor při hydrogenaci alkenů. Používání této látky zpopularizoval britský chemik Geoffrey Wilkinson, po kterém je také pojmenována.
| Wilkinsonův katalyzátor | |
|---|---|
Strukturní vzorec | |
Model molekuly | |

vzhled | |
| Obecné | |
| Systematický název | chloridotris(trifenylfosfan)rhodium |
| Sumární vzorec | C54H45ClP3Rh |
| Vzhled | tmavě červený prášek |
| Identifikace | |
| Registrační číslo CAS | 14694-95-2 |
| PubChem | 84599 |
| SMILES | [Rh+](P(C1=CC=CC=C1)(C2=CC=CC=C2)C3=CC=CC=C3)(P(C4=CC=CC=C4)(C5=CC=CC=C5)C6=CC=CC=C6)P(C7=CC=CC=C7)(C8=CC=CC=C8)C9=CC=CC=C9.[Cl-] |
| Vlastnosti | |
| Molární hmotnost | 925,22 g/mol |
| Teplota tání | 245 až 250 °C (518 až 523 K) |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech |
2 g/100 ml (trichlormethan, dichlormethan), 0,2 g/100 ml (benzen, toluen)[1] |
| Bezpečnost | |
| [2] Varování[2] | |
| S-věty | S22 S24/25 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
V minulosti se Wilkinsonův katalyzátor používal při polarizační spektroskopii indukované paravodíkem za účelem určit vlastnosti některých reaktivních látek,[3] nebo při jedněch z prvních podrobných kinetických výzkumech mechanismu katalytických reakcí.[4] Katalytické a kinetické studie s využitím Wilkinsonova katalyzátoru měly také značný význam v následném rozvoji kationtových katalyzátorů asymetrické hydrogenace založených na rutheniu a rhodiu, který vedl k vývinu moderní asymetrické katalýzy.[5]
Struktura a vlastnosti
Pomocí rentgenové krystalografie bylo zjištěno, že tato látka má mírně narušenou rovinnou čtvercovou strukturu.[6]
Z hlediska vazeb se jde o komplex jednomocného rhodia, tedy přechodného kovu s osmi d elektrony. Z hlediska pravidla 18 elektronů každý ze čtyř ligandů dodává po dvou elektronech, což je celkem 16 elektronů, a sloučenina je tedy elektronově nenasycená, v roztocích tedy prochází prudkou výměnou jak uvnitř molekuly (jedna z trifenylfosfinových skupin je nestabilní a neustále přechází mezi koordinační sférou rhodia a roztokem, tato rovnováha je ovšem výrazně posunuta ve prospěch výchozího komplexu, rovnovážná konstanta činí přibližně 10−5) tak i mezi molekulami.[7]
Příprava
Wilkinsonův katalyzátor se obvykle připravuje reakcí hydrátu chloridu rhoditého s přebytkem trifenylfosfinu v ethanolu.[8][9][1] Trifenylfosfin slouží jako dvouelektronové redukční činidlo které samo zvyšuje své oxidační číslo z III na V. V průběhu přípravy se tři ekvivalenty trifenylfosfinu stanou ligandy ve výsledném produktu, zatímco čtvrtý zredukuje trojmocné rhodium na jednomocné:
- RhCl3(H2O)3 + 4 P(C6H5)3 → RhCl[P(C6H5)3]3 + OP(C6H5)3 + 2 HCl + 2 H2O
Použití
Hydrogenace alkenů
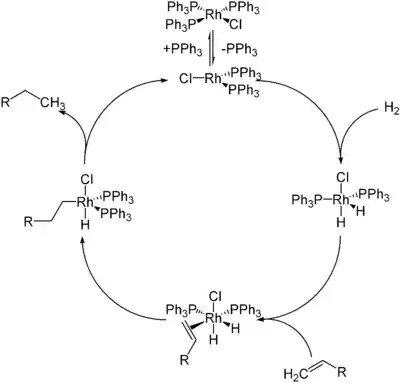
Wilkinsonův katalyzátor se nejčastěji využívá k homogenní katalýze hydrogenace alkenů molekulárním vodíkem.[10][11] Reakce začíná disociací jednoho nebo dvou trifenylfosfinových ligandů za vzniku čtrnáctielektronových či dvanáctielektronových komplexů, následně proběhne oxidační adice vodíku na kov, poté dojde k π komplexaci alkenu, migračnímu vložení (vnitromolekulárnímu přesunu hydridu nebo vložení alkenu) a po redukční eliminaci se vytvoří konečný alkanový produkt; například tak, jak je znázorněno na následujícím obrázku:
Rychlost hydrogenace je nejvíce ovlivňována mírou substituce alkenu, jelikož je určujícím krokem mechanismu migrační vložení, které při je velkém sterickém odporu v okolí kovového centra obtížné. Dobrými substráty bývají koncové a disubstituované alkeny, zatímco více stericky zatížené se hydrogenují pomaleji. Hydrogenace alkynů je problematická, jelikož mají alkyny snahu redukovat se na alkany za vzniku cis-alkenu jako meziproduktu.[12] Ethen s Wilkinsonovým katalyzátorem reaguje za tvorby RhCl(C2H4)(P(C6H5)3)2, ovšem není substrátem hydrogenace.[9]
Ostatní katalytické reakce
Wilkinsonův katalyzátor také katalyzuje mnoho dalších hydrofunkcionalizačních reakcí jako jsou hydroacylace, hydroborace a hydrosilylace alkenů.[12] Hydroborace byly zkoumány pomocí katecholboranu a pinakolboranu.[13] Též může sloužit k hydrosilylaci alkenů.[14]
Za přítomnosti vodíku a silné zásady Wilkinsonův katalyzátor vytváří reaktivní rhodné sloučeniny s vyšší aktivitou při hydrogenaci vnitřních alkenů a funkcionalizovaných trisubstituovaných alkenů.[15]
Reakce
Wilkinsonův katalyzátor reaguje s oxidem uhelnatým za vzniku bis(triphenylfosfin)rhodiumkarbonylchloridu, který lze rovněž získat dekarbonylací aldehydů;
- RhCl[P(C6H5)3]3 + RCHO → RhCl(CO)(P(C6H5)3)2 + RH + P(C6H5)3
při míchání v benzenovém roztoku se přeměňuje na málo rozpustný červeně zbarvený dimer [RhCl(P(C6H5)3)2]2, což je projevem nestability trifenylfosfinových ligandů; za přítomnosti zásady, H2 a nadbytku trifenylfosfinu se mění na hydridotetrakis(trifenylfosfin)rhodium(I) (HRh[P(C6H5)3]4). Tento 18elektronový komplex je také aktivním katalyzátorem hydrogenace.[16]
Reference
V tomto článku byl použit překlad textu z článku Wilkinson's catalyst na anglické Wikipedii.
- J. A. Osborn; G. Wilkinson. Tris(triphenylphosphine)halorhodium(I). Inorganic Syntheses. 1967, s. 67. ISBN 9780470132418. DOI 10.1002/9780470132418.ch12. (anglicky)
- Chlorotris(triphenylphosphine)rhodium(I). pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Simon B. Duckett; Connie L. Newell; Richard Eisenberg. Observation of New Intermediates in Hydrogenation Catalyzed by Wilkinson's Catalyst, RhCl(PPh3)3, Using Parahydrogen-Induced Polarization. Journal of the American Chemical Society. 1994, s. 10548–10556. DOI 10.1021/ja00102a023.
- Jack Halpern. Mechanistic aspects of homogeneous catalytic hydrogenation and related processes. Inorganica Chimica Acta. 1. 1. 1981, s. 11–19. Dostupné online. DOI 10.1016/S0020-1693(00)83716-0.
- John F. Hartwig. Organotransition metal chemistry- From bonding to Catalysis. [s.l.]: University Science Books, 2010. ISBN 978-1-891389-53-5. S. 10548–10556.
- Michael J. Bennett; Peter B. Donaldson. Crystal and molecular structure of the orange and red allotropes of chlorotris(triphenylphosphine)rhodium(I). Inorganic Chemistry. 1977, s. 655–660. DOI 10.1021/ic50169a033.
- Christina Moberg. Stereomutation in Trigonal-Bipyramidal Systems: A Unified Picture. Angewandte Chemie International Edition. 24. 10. 2011, s. 10290–10292. ISSN 1521-3773. DOI 10.1002/anie.201103375. PMID 22006818.
- M. A. Bennett; P. A. Longstaff. Complexes of Rhodium(I) with Triphenylphosphine. Chem. Ind. (London). 1965, s. 846. ISSN 1521-3773. DOI 10.1002/anie.201103375. PMID 22006818.
- J. A. Osborn; F. H. Jardine; J. F. Young; Geoffrey Wilkinson. The Preparation and Properties of Tris(triphenylphosphine)halogenorhodium(I) and Some Reactions Thereof Including Catalytic Homogeneous Hydrogenation of Olefins and Acetylenes and Their Derivatives. Journal of the Chemical Society A. 1966, s. 1711–1732. DOI 10.1039/J19660001711.
- Arthur Birch; D. H. Williamson. Homogeneous Hydrogenation Catalysts in Organic Synthesis. Organic Reactions. 1976, s. 1.
- B. R. James. Homogeneous Hydrogenation. [s.l.]: John Wiley & Sons, 1973. Dostupné online.
- Kevin Burgess; Wilfred A. van der Donk; Chul-Ho Jun; Young Jun Park. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2005. DOI 10.1002/047084289X.rc162s.pub2. Kapitola Chlorotris(triphenylphosphine)-rhodium(I).
- D. A. Evans; G. C. Fu; A. H. Hoveyda. Rhodium(I)-catalyzed hydroboration of olefins. The documentation of regio- and stereochemical control in cyclic and acyclic systems. Journal of the American Chemical Society. 1988, s. 6917–6918. DOI 10.1021/ja00228a068.
- I. Ojima; T. Kogure. Selective reduction of α,β-unsaturated terpene carbonyl compounds using hydrosilane-rhodium(I) complex combinations. Tetrahedron Letters. 1972, s. 5035–5038. DOI 10.1016/S0040-4039(01)85162-5.
- Jesus E. Perea Buceta; Israel Fernández; Sami Heikkinen; Kirill Axenov; Alistair W. T. King; Teemu Niemi; Martin Nieger. Diverting Hydrogenations with Wilkinson's Catalyst towards Highly Reactive Rhodium(I) Species. Angewandte Chemie International Edition. 23. 11. 2015, s. 14321–14325. ISSN 1521-3773. DOI 10.1002/anie.201506216.
- Eduardo Peña-Cabrera "Hydridotetrakis(triphenylphosphine)rhodium" Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons. DOI:10.1002/047084289X.rh030m
Externí odkazy
 Obrázky, zvuky či videa k tématu Wilkinsonův katalyzátor na Wikimedia Commons
Obrázky, zvuky či videa k tématu Wilkinsonův katalyzátor na Wikimedia Commons