Styren
Styren (fenylethen, vinylbenzen) je významná aromatická průmyslová chemikálie.
| Styren | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | ethenylbenzen |
| Triviální název | styren |
| Ostatní názvy | vinylbenzen, cinnamen, fenylethylen |
| Anglický název | Styrene |
| Německý název | Styrol |
| Sumární vzorec | C8H8 |
| Vzhled | bezbarvá až nažloutlá viskózní kapalina |
| Identifikace | |
| Registrační číslo CAS | 100-42-5 |
| Vlastnosti | |
| Molární hmotnost | 104,15 g/mol |
| Teplota tání | −30 °C |
| Teplota varu | 145 °C |
| Hustota | 0,909 g/cm³ |
| Rozpustnost ve vodě | < 1 % |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H226 H361d H332 H372 (sluchové orgány) H315 H319 |
| R-věty | R10 R20 R36/38 |
| S-věty | (S2) S23 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Za běžných podmínek jde o bezbarvou až nažloutlou kapalinu pronikavě nasládlého zápachu. Snadno těká, na vzduchu se oxiduje a vytvářejí se peroxidy, které působí jako katalyzátor polymerizace společně s dalšími parametry, jako je tlak, teplota, světlo a silné kyseliny. Proto se styren stabilizuje přídavkem inhibitorů, např. hydrochinonem. V přírodě se volně nenalézá, metabolicky však vzniká jako produkt rozkladu kyseliny skořicové. Je špatně rozpustný ve vodě, ale dobře se rozpouští v organických rozpouštědlech (alkoholy, aceton a sirouhlík aj.).
Použití
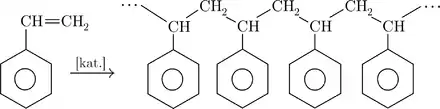
Je využíván při výrobě barviv, plastů, v gumárenském průmyslu. Jeho výskyt v atmosféře je především důsledkem antropogenní činnosti. Nejvýznamnější je jeho využití k polymeraci za účelem výroby jednoho z nejběžnějších plastů – polystyrenu. Ale využívá se i ve výrobě lepidel, fotografických filmů, inkoustů, automobilových součástek, obalových materiálů, plastového nádobí a řady dalšího spotřebního zboží.
Toxicita
Styren má narkotické a lokálně dráždivé účinky. Koncentrace 70 ppm ještě nevyvolává dráždění, koncentrace 100 ppm je snesitelná, koncentrace 200 ppm až 400 ppm vyvolává nepříjemný pocit zápachu. Nad koncentraci 400 ppm se projevuje dráždivý účinek, nad 800 ppm se projevuje narkotizační účinek a při koncentraci nad 1 300 ppm je již pobyt nesnesitelný. Nejsou vyloučeny pozdní účinky, například edém plic. Při požití je nepatrně jedovatější než benzen. Při styku s kůží dochází k jejímu vysušení a dráždění. Při styku s rohovkou dochází k dráždění až trvalému poškození. Chronická expozice se projevuje pseudoneurastenickými poruchami, změnami v jaterních funkcích a poklesem krevního tlaku. Mezi dalšími následky chronické expozice patří hepatotoxické účinky a atrofie sliznice horních cest dýchacích. Jako test expozice styrenu je možno použít analýzu kyseliny mandlové v moči. Mezinárodní agentura pro výzkum rakoviny (IARC) řadí styren mezi karcinogeny skupiny 2B .[2] Několik studií u pracovníků vystavených styrenu při výrobě plastů nalezlo zvýšený počet chromozomálních aberací v periferních lymfocytech.[3]
V životním prostředí
Po uvolnění do ovzduší se styren mění v benzaldehyd a formaldehyd. Poločas setrvání v ovzduší je kolem dvou hodin. V městském prostředí se styren vyskytuje v koncentracích okolo 0,3 μg/m³, ve znečištěném ovzduší až 20 μg/m³.[3]
Odkazy
Reference
- Styrene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-25]. Dostupné online. (anglicky)
- International Agency for Research on Cancer (IARC) - Summaries & Evaluations STYRENE (Group 2B)
- Miroslav Šuta: Chemické látky v životním prostředí a zdraví (Ekologický institut Veronica, Brno 2008, ISBN 978-80-87308-00-4)
Externí odkazy
 Obrázky, zvuky či videa k tématu Styren na Wikimedia Commons
Obrázky, zvuky či videa k tématu Styren na Wikimedia Commons - Styren charakteristika na stránce IRZ
- Bezpečnostní list styrenu[nedostupný zdroj] na stránkách firmy Unipetrol


