Glykoproteiny
Glykoproteiny jsou proteiny s navázanými sacharidy. Proces, kterým se tyto sacharidy na protein navazují, se označuje glykosylace. Jedná se o jednu z možných posttranslačních modifikací proteinů. Termín „glykoprotein“ by neměl být zaměňován s proteoglykany a peptidoglykany.
Biosyntéza
Glykosylace probíhá převážně v endoplazmatickém retikulu a v Golgiho aparátu. Podle typu vazby, kterou jsou sacharidy na proteiny navázány, dělíme glykoproteiny na N-glykoproteiny, O-glykoproteiny a nově také C-glykoproteiny a fosfoglykoproteiny. Enzymy katalyzující přenos a navázání sacharidů na proteiny se nazývají obecně glykosyltransferázy (např. galaktosyltransferáza – enzym přenášející galaktózu).
Kromě specifického, řízeného připojování sacharidů na proteiny může v organismu docházet i k nespecifickým, spontánním dějům – tzv. glykacím. Na rozdíl od glykosylací nespecifické glykace mohou poškodit funkci proteinů. Nespecifické glykace jsou problémem hlavně u lidí s cukrovkou, kteří při nedodržování diety trpí zvýšenou hladinou glukózy v krvi.
Glykoproteiny jsou typické hlavně pro eukaryota, nicméně glykosylované proteiny jsou známé i u prokaryot (převážně O-glykosylace).[1][2]
Skupiny glykoproteinů
Sacharidy jsou na protein vázány glykosidovou vazbou. Glykosidová vazba je speciální označení acetálové vazby u sacharidů. Sacharidy tvoří stabilní cyklické hemiacetály (reakcí jejich karbonylové skupiny s některou –OH na konci jejich řetězce), které jsou dále schopné reagovat s –OH nebo –NH2 skupinami (proteinů, jiných sacharidů, nukleotidových bází, ...) za tvorby acetálů.[3]
N-glykoproteiny
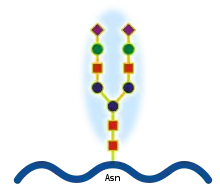
Oligosacharidy jsou vázány N-glykosidickou vazbou jsou na asparagin v sekvenci Asn-Xaa-Ser/Thr (kde Xaa může být jakákoliv aminokyselina kromě prolinu). K N-glykosylacím dochází v drsném endoplazmatickém retikulu během syntézy proteinu. Sacharidy se přenáší na protein en block (v kuse) v podobě tetradekasacharidu, který je pak dále v endoplazmatickém retikulu a Golgiho aparátu upravován. Důležitou roli v syntéze N-vázaných oligosacharidů hraje dolichol, izoprenoidní látka zakotvená v membráně endoplazmatického retikula, která slouží jako přenašeč sacharidů při syntéze.[4]
U prokaryot také můžeme nalézt N-glykoproteiny, proces syntézy je obdobný eukaryotickému.[5]
- přehled N-vázaných oligosacharidů (N-glykanů)
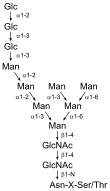 základní N-glykan (syntetizovaný v ER)
základní N-glykan (syntetizovaný v ER) komplexní (laktosaminový)typ N-glykanu
komplexní (laktosaminový)typ N-glykanu manózový typ N-glykanu
manózový typ N-glykanu hybridní typ N-glykanu
hybridní typ N-glykanu vzorec základního N-glykanu
vzorec základního N-glykanu 3D model základního N-glykanu
3D model základního N-glykanu
O-glykoproteiny
O-glykoproteiny jsou proteiny, které mají připojené sacharidy na –OH skupinách svých serinů / threoninů. K O-glykosylaci dochází převážně v jednotlivých oddílech Golgiho aparátu. Sacharidy jsou připojovány na protein postupně ( na rozdíl od N-vázaných oligosacharidů) bez dolicholového prekurzoru
- mucinový typ – nejrozšířenější typ O-glykoproteinů u savců. Muciny a podobné proteiny jsou sekretovány sliznicemi. Muciny často obsahují velké množství navázaných sacharidů (až 50% (w/w)) většinou ve formě kratších oligosacharidů. Základem je vždy α-N-acetylgalaktosamin (α-GalNAc) navázaný na serin nebo threonin. Nebyla definována žádná specifická sekvence, která by rozhodovala o tom, který serin nebo threonin bude glykosylován, nicméně tyto seriny/theroniny se nalézají v oblastech bohatých na serin, threonin, alanin a prolin. Dalším rozhodujícím faktorem jsou sekundární a terciární struktury.
- proteoglykanový typ (O-xylosylace) – další rozšířenou skupinou proteinů s O-vázanými polysacharidy jsou proteoglykany. Proteoglykany tvoří podstatnou složku extracelulární hmoty a sekretů sliznic. Sacharidovou složkou jsou často kyselé polysacharidy typu heparansulfát, chondroitinsulfát apod. Prvním krokem glykosylace proteoglykanů je přidání β-xylosy na serin / threonin, který je vzápětí rozšířen na oligosacharid:GlcAβ(1-3)Galβ(1-3)Galβ(1-4)Xylβ-Ser. K tomuto oligosacharidu jsou opakovaně přidávány další monosacharidy (N-acetylglukosamin (GlcNAc) a glukuronová kyselina (GlcA). Takto nasyntetizovaný polysacharidový řetězec je dále upravován (N-deacetylace, epimerizace GlcA na kyselinu idunoronovou a O- a N- sulfatace).[6]
- O-fukosylace – nově objevená O-glykosylace, která na rozdíl od ostatních neprobíhá v Golgiho aparátu, ale v endoplazmatickém retikulu.[7]
- O-GlcNAc glykosylace – vazba N-acetylglukosaminu (GlcNAc) na serin nebo threonin, na který už se většinou další sacharidy nevážou. Objevením tohoto typu glykosylace byla popřena dvě dogmata glykobiochemie: k O-GlcNAc glykosylaci dochází na rozdíl od ostatních glykosylací v cytoplasmě a jádře a O-GlcNAc není statickou modifikací, ale podobně jako fosforylace / defosfoylace proteinů slouží k rychlému ovlivnění funkce některých proteinů. Tento typ glykosylace se může podílet na regulaci transkripčních aktivit, enzymatických aktivit, ochraně před degradací proteinů proteasomem, nukleárním transportu.[8]
- O-manosylace [9]
C-glykoproteiny
C-glykoproteiny jsou poměrně nově objevená skupina glykoproteinů u savců, ve kterých je D-manosa navázaná C-glykosidovou vazbou na C-2 uhlík tryptofanu, který je v sekvenci Trp-Xaa-Trp. K úpravě dochází v endoplazmatickém retikulu a donorem manosy je dolichol-manosa (viz N-glykopreteiny). Role C-glykosylace je doposud nejasná.[10]
Fosfoglykoproteiny
Fosfoglykoproteiny zahrnují několik skupin proteinů, které mají na připojený sacharid na Thr / Ser proteinu přes fosfodiesterovou vazbu. Tento typ glykosylace zatím nebyl nalezen u savců, což ji činí potenciálním cílem pro vývoj nových léků.[11]
Využívané sacharidy
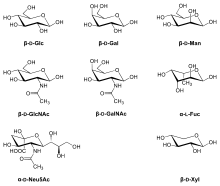
Sacharidy využívané v biosyntéze (včetně glykosylací) nejsou většinou používány přímo, ale teprve po navázání na nukleotidové přenašeče. Tyto přenašeče jsou různé pro jednotlivé sacharidy.
| UDP | GDP | CMP |
| glukóza | manóza | sialové kyseliny |
| N-acetylglukosamin | L-fukóza | - |
| galaktóza | - | - |
| N-acetylgalaktosamin | - | - |
| xylóza | - | - |
- příklady nukleotidových přenašečů s navázanými sacharidy
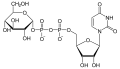 UDP-glukóza
UDP-glukóza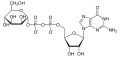 GDP-manóza
GDP-manóza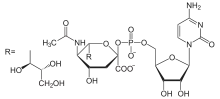 CMP-kyselina neuraminová (Sia)
CMP-kyselina neuraminová (Sia)
Funkce
Sacharidy v glykoproteinech mají různé funkce, jako například:
- interakce leukocytů s endotheliem kapilár v místě infekce
- vznik rezervoáru spermií v oviduktu (vejcovodu)
- degradace nesprávně sbalených proteinů v endoplasmatickém retikulu pomocí N-vázaných polymanosových oligosacharidů.[12]
Studium glykoproteinů
Detekce glykoproteinů
- metoda dle Duboise – obecná metoda stanovení sacharidů založená na dehydrataci sacharidů kyselinou sírovou za vzniku furfuralů a jejich následná kondenzace s fenolem, která dává vzniknout žlutohnědému produktu, jehož koncentrace (odpovídající koncentraci původního sacharidu / sacharidů se dá spektrofotometricky stanovit.
- specifické barvení glykoproteinů v polyakrylamidovém gelu – proteiny jsou rozděleny pomocí SDS elektroforesy (SDS-PAGE), získaný polyakrylamidový gel se inkubuje v roztoku kyseliny iodisté, která oxiduje sacharidové složky glykoproteinů na dialdehydy. Ty pak v následujícím kroku redukují Ag+. Glykoproteiny se objeví jako hnědé proužky
- lektinové studie – lektiny (proteiny, které jsou schopné specificky rozpoznávat a vázat určité mono- nebo oligosacharidy) se nechají zreagovat s proteiny. Jejich navázání je důkazem přítomnosti určitých (pro daný lektin specifických) sacharidových struktur.
Sekvenace oligo- a polysacharidů
Na rozdíl od proteinů nebo nukleových kyselin, sacharidy tvoří často větvené polymery, což výrazně komplikuje určování struktur. Navíc každý sacharid poskytuje většinou 5-6 míst (-OH skupin), na které se mohou další sacharidy vázat. Pro určení, které hydroxylové skupiny jsou v oligo/polysacharidu volné se používá methylačích činidel, která nespecificky methylují tyto –OH skupiny. Po hydrolýze a rozdělení na jednotlivé monosacharidy se určí, které –OH skupiny se účastní vazeb a které jsou volné Pro pořadí jednotlivých monosacharidů se využívá různých exoglykosidas (enzymů, které odštěpují sacharidy od vnějšího konce směrem k proteinu)
Studium protein-sacharidových interakcí
- Metoda ELBA – analogie k metodě ELISA. Na dno polystyrenových mikrotitračních destiček se připevní glykoprotein (nebo oligosacharid / polysacharid), pak se k němu přidá zkoumaný předem biotinylovaný protein, o němž se předpokládá, že by mohl rozpoznávat sacharidovou část glykoproteinu. Po promytí pokud došlo k interakci, tak biotinylový protein zůstává přichycen, což se vizualizuje pomocí avidin-peroxidasy (nebo avidin-alkalické fosfatasy). Během inkubace zkoumaných látek (glykoproteinu a biotinylovaného proteinu) se může do inkubační směsi přidat např. monosacharid/ oligosacharid a sleduje se případná inhibice interakce.
- Western blot
- Použití glykosidáz a glykosyltransferáz – pomocí těchto skupin enzymů se modifikují sacharidové složky glykoproteinů a sleduje se vliv těchto modifikací na dané protein-sacharidové interakce (zesílení, zeslabení, objevení, vymizení)
Odkazy
Reference
- Voet D, Voet JD, Pratt CW; Fundamentals of Biochemistry, 2006 John Wiley and sons
- Lodish et al.; Molecular Cell Biology, 2004, W.H. Freeman and Company
- McMurry J; Organic Chemistry, 2004, Brooks/Cole
- Weerapana E, Imperialy B, Asparagin-linked protein glycosylation: from eukaryotic to prokaryotic system, Glycobiology, vol 16, no.6 pp. 91R-101R, 2006
- Nita-Lazar M, Wacker M, Schegg B, Amber S, Aebi M.; The N-X-S/T consensus sequence is required but not sufficient for bacterial N-linked protein glycosylation, Glycobiology. 2005 Apr;15(4):361-7. Epub 2004 Dec 1
- Buskas T, Ingale S, Boons GJ, Glycopeptides as versatile tool for glycobiology, Glycobiology, vol.16, no.8, pp. 113R-136R, 2006
- Ma B, Simala-Grant JL, Taylor DE; Fucosylation in prokaryotes and eukaryotes, Glycobiology, vol.16, no12, pp. 158R-184R, 2006
- Guinez C, Morelle W, Michalski JC, Lefebvre T; O-GlcNAc glycosylation: a signal for the nuclear transport of cytosolic proteins,...,37 (2005) 765-774
- Endo T; Structure, function and pathology of O-mannosyl glycans; Glycoconjugate Journal 21, 3-7, 2004
- Vliegenthart JFG, Casset F; Novel forms of protein glycosylation; Curr. Opin. Struct. Biol.; 8, 565-571,(1998)
- Haynes PA; Phosphoglycosylation: a new structural class of glycosylation? Glycobiology,8, 1-5 (1998)
- Spiro RG; Role of N-linked polymannose oligosaccharides in targeting glycoproteins for endoplasmatic reticulum-associated degradation; CMLSm Cell. Mol. Life Sci. 61 (2004), 1025-1041
Literatura
Externí odkazy
 Obrázky, zvuky či videa k tématu glykoproteiny na Wikimedia Commons
Obrázky, zvuky či videa k tématu glykoproteiny na Wikimedia Commons - ekniha (Essential of glycobiology)