Avidin-peroxidáza
Avidin-peroxidáza (též avidin-peroxidasa) je modifikovaná peroxidáza (nejčastěji získávaná z křenu selského, Armoracia rusticana), na kterou je kovalentně připojen protein avidin (z vaječného bílku).
Použití
Avidin-peroxidáza se velmi často používá v laboratoři k vizualizaci různých biochemických interakcí (protein-proteinových, protein-sacharidových, …), u nichž jeden z účastníků této interakce je modifikován biotinem. Avidin je schopen se specificky a velmi silně vázat na biotin a přes tzv. avidin-biotinový můstek je tedy schopen připojit peroxidasu k interagujícím látkám.
Peroxidáza pak po dodání zdroje peroxidu (H2O2, NaBO3, …) a vhodného substrátu (jenž oxiduje a změní jeho vlastnosti –barva, rozpustnost) vizualizuje tuto interakci. Příkladem vhodných substrátů můžou být 4-chloro-1-naftol - po oxidaci dochází ke vzniku nerozpustné fialové látky – a ABTS (2,2'-azino-bis(3-ethylbenzthiazolin-6-sulfonát), který tvoří stabilní, zeleně zbarvené rozpustné radikály.
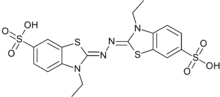
Avidin peroxidasy se často využívá při metodě ELISA a ELBA metodě a při western blotu. Podobně jako avidin-peroxidasa se však také často využívá kyselá nebo alkalická avidin-fosfatáza.
Stavební částice
Křenová peroxidáza
| křenová peroxidáza | |
|---|---|
| alternativní názvy | HRP, horseradish peroxidase |
| zdroj | křen selský (Armoracia rusticana) |
| molekulová hmotnost | ~44 000[1] |
| počet isoenzymů | 7[2] |
| pI | 3-9 |
| pH optimum | 6-6,5[3] |
| inhibitory | CN−, S2−, F−, N3−, Fe3+,[4] |
Avidin
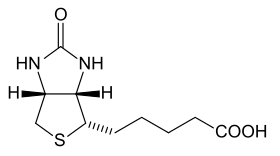
| avidin | |
|---|---|
| zdroj | vaječný bílek |
| molekulová hmotnost | homotetramer, celková Mr = 66-69 000 |
| pI | 10,5 |
| biologická funkce | antimikrobiální agents, vyvazuje biotin nutný pro růst bakterii (KD(avidin-biotin) = 1,10-15M) |
Podobně jako avidin se používá i streptavidin - protein o podobných vlastnostech jako avidin (silná a specifická vazba biotinu) izolovaný z Streptomyces avidinii. Na rozdíl od avidinu není streptavidin vůbec glykosylován.
Používané substráty avidin peroxidázy
| zkratka | název | rozpustnost produktu |
| DAB | 3,3'diaminobezidin | N |
| 4-CN | 4-chloro-1-naftol | N |
| HYR | Hanker-Yaks reagent | N |
| AEC | 3-amino-9-ethylethanol | N |
| TMB | 3,3',5,5'-tetrametylbenzidin | N |
| OPD | o-fenylendiamin | R |
| ABTS | 2,2'-azino-bis(3-ethylbenzthiazolin-6-sulfonát | R |
Příprava avidin-peroxidázy
Křenová peroxidáza je kovalentně připojena na avidin pomocí bismaleimidu (dimaleimidu) v poměru přibližně 2:1 (HRP:avidin)[5]
Odkazy
Reference
- Welinder, K.G., Eur. J. Biochem., 96, 483–502 (1978)
- Shannon, L.M., et al., J. Biol. Chem., 241, 2166–2172 (1966).
- Schomberg, D., Salzmann, M., and Stephan, D., Enzyme Handbook 7, EC 1.11.1.7:1–6 (1993).
- Zollner, H., Handbo]ok of Enzyme Inhibitors, 2nd Ed., Part A: 367–368 (1993).
- O'Sullivan MJ, et al, FEBS letters, 35, 311-313 (1978).