Jacobsenův katalyzátor
Jacobsenův katalyzátor je obvyklé pojmenování N,N'-bis(3,5-di-terc-butylsalicyliden)-1,2-cyklohexandiaminochloridu manganitého, komplexní sloučeniny manganu a salenového ligandu. Používá se jako asymetrický katalyzátor při Jacobsenově epoxidaci, kterou lze použít k enantioselektivní přeměně prochirálních alkenů na epoxidy.[2][3] Před objevem Jacobsenova katalyzátoru se k asymetrické epoxidaci alkenů musely používat katalyzátory s řídícími funkčními skupinami, například alkoholovou, tak jako při Sharplessově epoxidaci.[4] Látka má dva enantiomery; stereochemie produktu závisí na použité enantiomerní formě katalyzátoru.
| Jacobsenův katalyzátor | |
|---|---|
.png.webp)
Strukturní vzorec | |
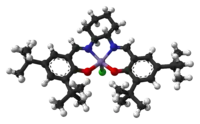
Model molekuly | |
| Obecné | |
| Systematický název | N,N'-bis(3,5-di-terc-butylsalicyliden)-1,2-cyklohexandiaminochlorid manganitý |
| Sumární vzorec | C36H52ClMnN2O2 |
| Vzhled | hnědá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 149656-63-3 |
| EC-no (EINECS/ELINCS/NLP) | 604-063-0 |
| SMILES | CC(C)(C)c1cc2/C=[N+]5/[C@H]4CCCC[C@@H]4/[N+]6=C/c3cc(cc(c3O[Mn-2]56(Cl)Oc2c(c1)C(C)(C)C)C(C)(C)C)C(C)(C)C |
| InChI | 1S/C36H54N2O2.ClH.Mn/c1-33(2,3)25-17-23(31(39)27(19-25)35(7,8)9)21-37-29-15-13-14-16-30(29)38-22-24-18-26(34(4,5)6)20-28(32(24)40)36(10,11)12;;/h17-22,29-30,39-40H,13-16H2,1-12H3;1H;/q;;+3/p-3/t29-,30-;;/m1../s1 |
| Vlastnosti | |
| Molární hmotnost | 635,20 g/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H315 H319 H335 |
| P-věty | P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337 P362 P403+233 P405 P501 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Enantiomerně čisté epoxidy jsou důležité jakožto základní molekuly při přípravě složitějších molekul s určitou chiralitou. Vlastnosti biologicky aktivních látek mohou být značně odlišné i u dvou molekul, které se liší pouze chiralitou.[5] Jacobsenův i ostatní asymetrické katalyzátory jsou tedy velmi užitečné; například samotný Jacobsenův katalyzátor se používá při čtyřstupňové syntéze fenylisoserinu, který tvoří postranní řetězec taxolu.[6]
Struktura a vlastnosti
Jacobsenův katalyzátor je typickým oxidačním katalyzátorem tvořeným přechodným kovem; má kovové centrum navázané na dusíkový a kyslíkový donor.[4] Salenový ligand v jeho molekule je tetradentátní, atom manganu tedy na sebe váže čtyřmi vazbami, po jedné z každého atomu dusíku a kyslíku salenového řetězce. Patří mezi chirální diiminové ligandy připravované kondenzačními reakcemi ze Schiffových bází.[5]
Příprava
Příprava Jacobsenova katalyzátoru začíná oddělením jednotlivých enantiomerů 1,2-diaminocyklohexanu a následnou reakcí příslušného vinanu s 3,5-di-terc-butyl-2-hydroxybenzaldehydem za vzniku Schiffovy báze. Reakcí s octanem manganatým na vzduchu se vytvoří manganitý komplex, který lze po přidání chloridu lithného izolovat jako chlorid. Na obrázku níže je znázorněna příprava (R,R)-enantiomeru.[7]
Mechanismus reakce
Byly navrženy dva možné mechanismy fungování Jacobsenova katalyzátoru.[8] Protože se za jeho přítomnosti nejsnadněji epoxidují konjugované alkeny, tak bývá nejčastěji přijímán mechanismus, při kterém vzniká radikálový meziprodukt stabilizovaný konjugovanými vazbami. Při použití nekonjugovaných alkenů nedochází ke stabilizaci radikálu a radikálový mechanismus je méně pravděpodobný; místo něj reakce pravděpodobně probíhá soustředěným mechanismem, i když se ukazuje, že by i zde mohl vznikat radikálový meziprodukt.[8]
Původně byly k oxidaci používány jodosylareny (C6H5IO) ve stechiometrických množstvích, ovšem záhy byly nahrazeny levnějším a podobně účinným chlornanem sodným (NaClO), který se nyní používá nejčastěji, i když může být nahrazen jinými látkami.[8]
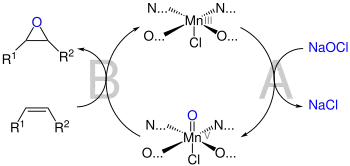
Po přidání oxidačního činidla se vytvoří O=Mn5+ jakožto aktivní oxidant (A). Substrát se k vazbě kov-kyslík přiblíží ve svislém směru vzhledem k molekule katalyzátoru, čímž dojde k ideálnímu překryvu orbitalů. Tento mechanismus poprvé navrhl John Groves k vysvětlení epoxidací katalyzovaných porfyriny.[9] K přiblížení dochází okolo diaminového můstku, kde není ztěžováno sterickými jevy vytvářenými terc-butylovými skupinami na okraji ligandu.[3] Způsob přiblížení alkenu je stále předmětem diskuzí.[8]
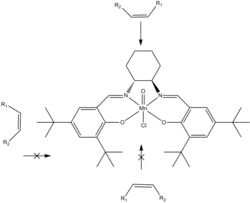
Pomocí Jacobsenova katalyzátoru lze snadno epoxidovat cis-alkeny, ovšem epoxidace trans- a koncových alkenů je obtížnější,[3] což se dá zlepšit změnou struktury ligandu;[8] například deriváty Jacobsenova katalyzátoru s drobnými odchylkami ve struktuře salenového jádra lze při nízkých teplotách za přítomnosti kyseliny m-chlorperoxobenzoové použít k epoxidaci styrenu.[10] Při nízké teplotě je upřednostňována oxidace pouze cis-alkenů; kyselina m-chlorperoxobenzoová se používá kvůli příliš vysoké teplotě tuhnutí vody. Pokusy o epoxidaci trans-alkenů pomocí sloučenin manganu nebyly úspěšné, k tomu však lze použít komplexy s jinými kovy, jako jsou komplexy s chromem.[8][11]
Obměny
Strukturu ligandu Jacobsenova katalyzátoru lze snadno pozměnit a umožnit tak provedení řady dalších reakcí, jako jsou otevírání epoxidových cyklů, Dielsovy–Alderovy reakce a konjugované adice.[12][13] Podobný katalyzátor s kovovým centrem tvořeným hliníkem byl použit na karbonylaci epoxidů za účelem přípravy beta-laktonů.[14]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Jacobsenův katalyzátor na Wikimedia Commons
Obrázky, zvuky či videa k tématu Jacobsenův katalyzátor na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Jacobsen's catalyst na anglické Wikipedii.
- (R,R)-Jacobsen's catalyst. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Wei Zhang; J. L. Sharkey; S. R. Wilson; Eric Jacobsen. Enantioselective epoxidation of unfunctionalized olefins catalyzed by salen manganese complexes. Journal of the American Chemical Society. 1990, s. 2801–2803.
- Eric Jacobsen; Wei Zhang; Alexander R. Muci; James R. Ecker; Li Deng. Highly enantioselective epoxidation catalysts derived from 1,2-diaminocyclohexane. Journal of the American Chemical Society. 1991, s. 7063.
- Robert H. Crabtree. The Organometallic Chemistry of the Transition Metals. [s.l.]: Wiley, 2005. Dostupné online. ISBN 978-0-471-66256-3. S. 405–408.
- C. A. Caputo; N. D. Jones. Developments in Asymmetric Catalysis by Chiral Chelating Nitrogen-Donor Ligands. Dalton Transactions. 2005, s. 1563–1602.
- L. Deng; E. N. Jacobsen. A Practical, Highly Enantioselective Synthesis of the Taxol Side Chain via Asymmetric Catalysis. The Journal of Organic Chemistry. 1992, s. 4320–4323.
- LARROW, JF; JACOBSEN, EN. (R,R)-N,N'-Bis(3,5-Di-tert-Butylsalicylidene)-1,2-Cyclohexanediamino Manganese(III) Chloride, A Highly Enantioselective Epoxidation Catalyst. Org. Synth.. 1998, s. 1. Dostupné online. (anglicky)
- E. M. McGarrigle; D. G. Gilheany. Chromium- and Manganese-salen Promoted Epoxidation of Alkenes. Chemical Reviews. 2005, s. 1563–1602. PMID 15884784.
- J. T. Groves; T. E. Nemo. Epoxidation Reactions Catalyzed by Iron Porphyrins - Oxygen Transfer from Iodsylbenzene. Journal of the American Chemical Society. 1983, s. 5786–5791.
- M. Palucki; P. J. Pospisil; W. Zhang; E. N. Jacobsen. Highly Enantioselective, Low-Temperature Epoxidation of Styrene. Journal of the American Chemical Society. 1994, s. 9333–9334.
- A. M. Daly; M. F. Renehan; D. G. Gilheany. High Enantioselectivities in an (E)-Alkene Epoxidation by Catalytically Active Chromium Salen Complexes. Insight into the Catalytic Cycle. Organic Letters. 2001, s. 663–666. PMID 11259031.
- E. N. Jacobsen. Asymmetric Catalysis of Epoxide Ring-Opening Reactions. Accounts of Chemical Research. 2000, s. 421–423. PMID 10891060.
- T. P. Yoon; E. N. Jacobsen. Privileged Chiral Catalysts. Science. 2003, s. 1691–1693. PMID 12637734.
- Getzler, YDYL; V. Mahadevan; E. B. Lobkovsky; G. W. Coates. Highly Enantioselective, Low-Temperature Epoxidation of Styrene. Journal of the American Chemical Society. 2002, s. 1174–1175.

-Jacobsen's_catalyst.png.webp)