Sharplessova epoxidace
Sharplessova epoxidace je organická reakce sloužící k enantioselektivní přípravě 2,3-epoxyalkoholů z primárních a sekundárních allylalkoholů.[1][2]
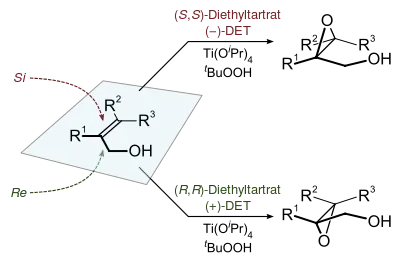
Na stereochemii vzniklého má vliv enantiomer použitého vinanu. Jako oxidační činidlo se používá terc-butylhydroperoxid. Enantioselektivitu zajišťuje kromě vinanu také katalyzátor, kterým je isopropoxid titaničitý. Za přítomnosti 3Å molekulových sít je potřebné množství katalyzátoru jen asi 10 až 15 molárních procent.[3]
Sharplessova epoxidace se používá velmi často, a to díky pěti faktorům. Prvním je to, že epoxidy lze snadno přeměnit na dioly, aminoalkoholy nebo ethery, takže je při výrobě přírodních látek potřebná tvorba chirálních epoxidů. Druhým důvodem je možnost použití velkého počtu primárních i sekundárních alkoholů. Třetí výhodou je, že produkty mají často enantiomerní přebytek přes 90 %, čtvrtou výhodu představuje možnost předvídat produkty reakce. Poslední z těchto výhod je dostupnost a nepříliš vysoká cena reaktantů.[4]
Bylo vydáno několik prací zabývajících se Sharplessovou epoxidací.[5][6][7][8]
Karl Barry Sharpless obdržel roku 2001 Nobelovu cena za chemii za práci na chirálně katalyzovaných oxidačních reakcích.
Struktura katalyzátoru
Struktura aktivního katalyzátoru není spolehlivě známa, pravděpodobně však jde o dimer [Ti(vinan)(OR)2].[9]
Selektivita
Chiralita produktů Sharplessovy epoxidace se často odvozuje takto: kolem dvojné vazby se nakreslí obdélník v rovině uhlíkových atomů tvořících tuto vazbu, s allylalkoholem v pravém spodním rohu a ostatními substituenty v odpovídajících rozích. Při tomto uspořádání (−) diester kyseliny vinné přednostně interaguje s vrchní polovinou molekuly a (+) diester s dolní polovinou. Selektivita se snižuje s rostoucí velikostí skupiny R1, ale zvyšuje s velikostmi skupin R2 R1 a R3.[1]
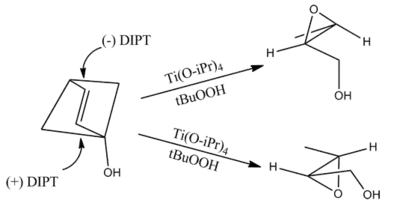
Tento model však nesprávně předpovídá chiralitu produktů epoxidace 1,2-diolů.[10]
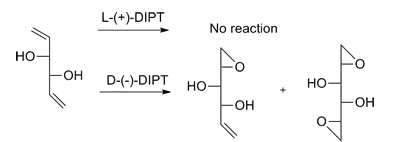
Využití
Sharplessovu epoxidaci lze provést u velkého počtu primárních a sekundárních alkenolů. Dialkylestery kyseliny vinné se většinou připojují na stejné strany molekul nezávisle na substituentech alkenu.[1] Aby ukázal syntetickou užitečnost této reakce, tak Sharpless vytvořil meziprodukty syntézy několika přírodních látek, jako jsou methymycin, erythromycin a leukotrien C-1.[11]
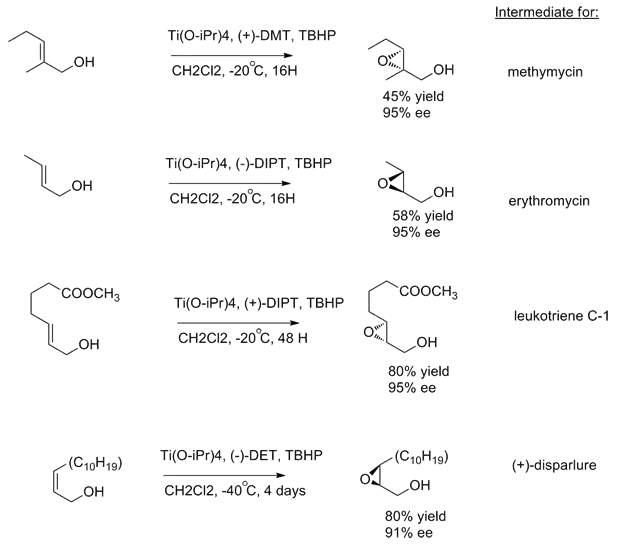
Jelikož šlo v době jejího objevu o jednu z mála známých vysoce enantioselektivních reakcí, tak bylo vyvinuto mnoho různých variant Sharplessovy reakce k přípravě velkého počtu 2,3-epoxyalkoholů.[12]
Sharplessova epoxidace je součástí totálních syntéz řady různých látek, jako jsou sacharidy, terpeny, leukotrieny, feromony a antibiotika.[4]
Hlavní nevýhodou tohoto postupu je potřeba přítomnosti allylalkoholu. Jiným druhem enantioselektivní epoxidace je Jacobsenova epoxidace, při které allylalkohol není nutný a mohou při ní být přítomny funkční skupiny, jejichž přítomnost Sharplessově oxidaci není vhodná.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Sharplessova epoxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sharplessova epoxidace na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Sharpless epoxidation na anglické Wikipedii.
- T. Katsuki; K. B. Sharpless. The first practical method for asymmetric epoxidation. Journal of the American Chemical Society. 1980, s. 5974.
- J. G. Hill; K. B. Sharpless; C. M. Exon; R. Regenye. Enantioselective Epoxidation Of Allylic Alcohols: (2s,3s)-3-propyloxiranemethanol. Organic Syntheses. 1985, s. 66.
- Y. Gao; R. M. Hanson; J. M. Klunder; S. Y. Ko; H. Masamune; K. Barry Sharpless. Catalytic asymmetric epoxidation and kinetic resolution: Modified procedures including in situ derivatization. Journal of the American Chemical Society. 1987, s. 5765–5780.
- C. F. Uetikon. Synthesis. 1986, s. 88–116.
- R. A. Johnson; K. Barry Sharpless. Addition Reactions with Formation of Carbon–Oxygen Bonds: (ii) Asymmetric Methods of Epoxidation. Compr. Org. Synth.. 1991, s. 389–436. ISBN 978-0-08-052349-1.
- E. Hüft. Enantioselective epoxidation with peroxidic oxygen. Topics in Current Chemistry. 1993, s. 63–77. ISBN 978-3-540-56252-8.
- T. Katsuki; V. S. Martin. Organic Reactions. 1996, s. 1–300.
- A. Pfenninger. Asymmetric Epoxidation of Allylic Alcohols: The Sharpless Epoxidation. Synthesis. 1986, s. 89–116. ISBN 978-3-540-56252-8.
- M. G. Finn; Karl Barry Sharpless. Mechanism of asymmetric epoxidation. 2. Catalyst structure. Journal of the American Chemical Society. 1991, s. 113–126.
- S. Takano; Y. Iwabuchi; K. Ogasawara. Inversion of enantioselectivity in the kinetic resolution mode of the Katsuki-Sharpless asymmetric epoxidation reaction. Journal of the American Chemical Society. 1991, s. 2786–2787.
- B. Rossiter; T. Katsuki; K. Barry Sharpless. Asymmetric epoxidation provides shortest routes to four chiral epoxy alcohols which are key intermediates in syntheses of methymycin, erythromycin, leukotriene C-1, and disparlure. Journal of the American Chemical Society. 1981, s. 464–465.
- K. Barry Sharpless; C. H. Behrens; T. Katsuki; A. W. M. Lee; V. S. Martin; M. Takatani; S. M. Viti. Stereo and regioselective openings of chiral 2,3-epoxy alcohols. Versatile routes to optically pure natural products and drugs. Unusual kinetic resolutions. Pure Applied Chemistry. 1983, s. 58.