Hexafluoraceton
Hexafluoraceton (zkráceně HFA) je organická sloučenina se vzorcem (CF3)2CO, patřící mezi fluorované ketony. Je odvozena od acetonu nahrazením všech šesti vodíkových atomů atomy fluoru. Jedná se o bezbarvý hygroskopický nehořlavý a velmi reaktivní plyn s plesnivým zápachem.[2]
| Hexafluoraceton | |
|---|---|
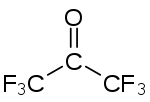
Strukturní vzorec | |
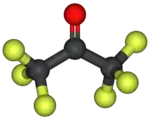
Model molekuly | |
| Obecné | |
| Systematický název | hexafluorpropan-2-on, 1,1,1,3,3,3-hexafluorpropan-2-on |
| Ostatní názvy | perfluoraceton, perfluorpropanon, HFA |
| Funkční vzorec | CF3C(O)CF3 |
| Sumární vzorec | C3F6O |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 684-16-2 |
| EC-no (EINECS/ELINCS/NLP) | 211-676-3 |
| PubChem | 12695 |
| ChEBI | 39429 |
| SMILES | FC(F)(F)C(=O)C(F)(F)F |
| InChI | 1/C3F6O/c4-2(5,6)1(10)3(7,8)9 |
| Vlastnosti | |
| Molární hmotnost | 166,02 g/mol |
| Teplota tání | −129 °C (144 K) |
| Teplota varu | −28 °C (245 K) |
| Hustota | 1,32 g/cm3 |
| Rozpustnost ve vodě | reaguje |
| Tlak páry | 590 kPa (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H280 H301 H310 H311 H314 H315 H318 H330 H360 H370 H372 |
| P-věty | P201, P202, P260, P262, P264, P270, P271, P280, P281, P284, P301+330+331, P301+310 P302+350, P302+352, P303+361+353, P304+340, P305+351+338, P307+311, P308+313, P310, P312, P314, P320, P321, P322 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Nejčastěji se nachází ve formě seskvihydrátu (·1,5 H2O), který je sám hemihydrátem hexafluoropropan-2,2-diolu, patřícího mezi geminální dioly.
Výroba a příprava
Průmyslově se hexafluoraceton vyrábí reakcí hexachloracetonu s kyselinou fluorovodíkovou:[3]
- (CCl3)2CO + 6 HF → (CF3)2CO + 6 HCl
V laboratoři jej lze získat dvoustupňovou syntézou z hexafluorpropenu, který v prvním kroku reaguje za přítomnosti fluoridu draselného s elementární sírou za vzbiku 1,3-dithietanu [(CF3)2CS]2. Tato látka se následně oxiduje jodičnanem na hexafluoraceton.[4]
Použití
Hexafluoraceton se používá na výrobu hexafluor-propan-2-olu následující reakcí:
- (CF3)2CO + H2 → (CF3)2CHOH
Také slouží jako prekurzor dalších sloučenin, kterými jsou:
- hexafluorisobuten, (CF3)2C=CH2, monomer.[3]
- midaflur
- bisfenol AF
- 4,4′-(hexafluorisopropyliden)diftalanhydrid
Reaktivita
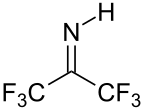
Hexafluoraceton je elektrofilní látka, nukleofily s ním reagují na karbonylovém uhlíku. Ve vodě se vyskytuje převážně ve formě hydrátu. Rovnovážná konstanta tvorby geminálního diolu je přibližně 106, zatímco u acetonu má hodnotu asi 10−3.[5] Hydráty hexafluoracetonu jsou kyselé povahy. Adicí amoniaku na hexafluoraceton vzniká poloaminal (CF3)2C(OH)(NH2), který lze dehydratovat fosforylchloridem za vzniku iminu (CF3)2C=NH.[6]
Odkazy
Související články
- Bromaceton
- Chloraceton
- Fluoraceton
- Trifluoraceton
- Novec 1230
- Hexafluorthioaceton
Externí odkazy
 Obrázky, zvuky či videa k tématu Hexafluoraceton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hexafluoraceton na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Hexafluoroacetone na anglické Wikipedii.
- Hexafluoroacetone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- CDC - NIOSH Pocket Guide to Chemical Hazards
- Günter Siegemund; Werner Schwertfeger; Andrew Feiring; Bruce Smart; Fred Behr; Herward Vogel; Blaine McKusick. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a11_349. Kapitola Fluorine Compounds, Organic.
- M. VAN DER PUY, L. G. ANELLO. Hexafluoroacetone. Org. Synth.. 1990. Dostupné online. (anglicky); Coll. Vol.. S. 251. (anglicky)
- David M. Lemal. Perspective on Fluorocarbon Chemistry. The Journal of Organic Chemistry. 2004, s. 1–11. PMID 14703372.
- W. J. Middleton; H. D. Carlson. Hexafluoroacetone imine. Organic Syntheses. 1970, s. 81–83.




