Borol
Boroly jsou skupina pětičlenných heterocyklů obsahujících borolový cyklus, pětičlenný kruh s jedním atomem boru a dvěma dvojnými vazbami. Lze je považovat za strukturní analogy cyklopentadienů, pyrrolů, či furanů. Borol je isoelektronický s cyklopentadienylovým kationtem, C5H +
5 (Cp+) a obsahují čtyři π elektrony. I když na borol nelze dobře použít Hückelovo pravidlo, tak bývá považován za antiaromatickou sloučeninu, protože má 4 π elektrony.[1] Boroly mají díky tomu jedinečné elektronové vlastnosti, které se nevyskytují u jiných metalolů.
| Borol | |
|---|---|
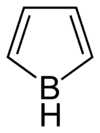
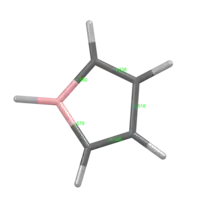
Strukturní vzorec | |
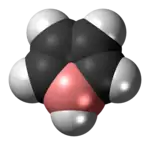
Model molekuly | |
| Obecné | |
| Systematický název | 1H-borol |
| Sumární vzorec | C4H5B |
| Identifikace | |
| Registrační číslo CAS | 287-87-6 |
| PubChem | 101923629 |
| SMILES | C1=CC=CB1 |
| InChI | 1S/C4H5B/c1-2-4-5-3-1/h1-5H |
| Vlastnosti | |
| Molární hmotnost | 63,89 g/mol |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Základní sloučenina se vzorcem C4H5B byla dosud izolována pouze v komplexech s přechodnými kovy.[2]
Byly připraveny substituované boroly s různými substituenty na jednotlivých uhlících i na boru.[3] Nízká elektronová hustota umožňuje řadu různých reakcí, jako jsou například aktivace vodíků nevázaných na kovy a přesmyky po cykloadicích, nepozorované u strukturních analogů pyrrolu a furanu.
Po redukci na dianion se vzniklý boroldiidový komplex stává aromatickým a účastní se podobných reakcí jako anion Cp−, například vytváří sendvičové komplexy.
Elektronové vlastnosti
Hückelovská analýza
Podle Hückelova pravidla má aromatická molekula mít (4n + 2) a antiaromatická 4n π elektronů, boroly tak patří mezi antiaromatické sloučeniny. Podle ab initio výpočtů byl u borolu (C4H4BH) předpověděn antiaromatický singletový základní stav.[3]
V molekule se střídají délky jednotlivých vazeb, což odpovídá lokalizaci elektronů v π systému. Tuto vlastnost mají téměř všechny deriváty borolu, s výjimkou těch, které jsou odvozeny od [PhBC4Ph4].[4] Vysvětluje se vnitrolekulární fenyl→borovou π donací uvnitř dimerových jednotek.
Ukázalo se rovněž to, že borol je významně destabilizován delokalizací čtveřice π elektronů. S využitím ultrafialovo-viditelné spektroskopie a studií reaktivity byla antiaromaticita borolů potvrzena. Jejich antiaromaticita způsobuje elektrofilitu borového centra a tak i slabé donory, jako jsou ethery a nitrily, mohou vytvořit stabilní adukty. Vysoce aktivované uhlíkové řetězce borolů také snadno vstupují do Dielsových–Alderových reakcí a do dvouelektronových redukcí, jejichž produkty jsou boroldiidy.
Jednoduchý Hückelův model lze použít ke srovnání spektroskopických vlastností a reaktivity borolů s izoelektronovými cyklopentadienylovými kationty [C5H5]+. Oproti [C5H5]+, které mají dvojitě degenerovaný pár HOMO bor navyšuje energie u antisymetrických molekulových orbitalů a ještě výrazněji u symetrických molekulových orbitalů. HOMO u borolů jsou tak dvojnásobně obsazené a mají biradikálový charakter. Boroly mají též malé rozdíly energií mezi HOMO a LUMO a nejméně energetická absorpce elektronu u borolů vykazuje významný červený posuv v ultrafialovo-viditelném spektru (například u [PhBC4Ph4] je λmax 560 nm). To způsobuje modré zbarvení borolů.
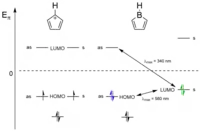
Přidáním dvou elektronů do prázdného LUMO redukcí nebo tvorbou aduktu s Lewisovou zásadou zvětšuje rozdíl energie mezi HOMO a LUMO, čímž dochází k výraznému modrému posuvu nejnižší excitační energie (u [PhBC4Ph4]·pyridinu činí λmax 340 nm) a vzniklá sloučenina má obvykle žlutou až červenou barvu. Kvalitativní znázornění tohoto stavu je na obrázku výše zobrazeno vlevo. Malý rozdíl energií HOMO a LUMO způsobuje, že se boroly velmi dobře zapojují do Dielsových–Alderových reakcí se sebou samými nebo s různými alkeny a alkyny.
Přirozené vazebné orbitaly
Za účelem porozumění vazbám v C4H4BH byla provedena analýza přirozených vazebných orbitalů.[5] Bylo zjištěno, že zaplněnost dvou C-C π orbitalů je okolo 1,9, přičemž malá část náboje (obsazenost 0,13) je delokalizována na p orbitalu boru. Lewisovská struktura borolu zaujímá přes 50 % celkové elektronové struktury. Protože delokalizaci čtyř π elektronů brání antiaromaticita, tak má nenasycený bor nízkou zaplněnost prázdného pz orbitalu a je silnou Lewisovou kyselinou. V důsledku nízké energie LUMO jsou boroly náchylné k tvorbě aduktů i se substráty, které jsou slabými donory.
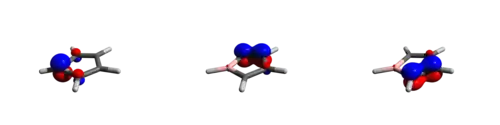
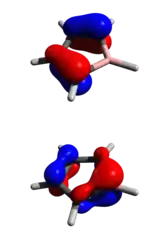
Protože je p orbital téměř prázdný a nevazebný (jak naznačuje jeho energie na úrovni nevazebného orbitalu), tak je borol dobrou Lewisovou kyselinou a akceptorem elektronů. Za běžných podmínek je borol velmi reaktivní a nestálý. Pentafenylborolový analog je velmi reaktivní zelená pevná látka, která snadno podléhá oxidaci, částečné protonolýze a Dielsovým–Alderovým reakcím s dienofily. Borol je značně nestabilní i v perarylované formě. Vzhledem k této značné reaktivitě nejsou strukturní a termochemické vlastnosti čistého borolu známy.
V optimalizované struktuře znázorněné vlevo jsou délky vazeb B1C, 1C2C a 2C2C postupně 1,58, 1,338 a 1,518 Å. Delší vazba 2C2C u C4H4BH odpovídá výsledkům analýzy nevazebných orbitalů a potvrzuje delokalizaci π elektronů na methynových uhlících a tím i antiaromaticitu neutrálního borolu.
Borolové dianionty (boroldiidy)
Protože má bor prázdný orbital p, tak mají boroly sklon k přijímání dvojice elektronů, čímž získávají 6 π elektronů. Tato redukce na boroldiidy byla provedena v 80. letech 20. století izolací K2[PhBC4Ph4].[7] Protože mají atomové orbitaly boru jiné energie než u uhlíku, tak do π systému nepřispívají všechny atomy rovnoměrně. Výpočty na základě teorie přirozené rezonance[6] bylo zjištěno, že izolovaný dianion [C4BH5]2− vytváří 3 hlavní rezonanční struktury.
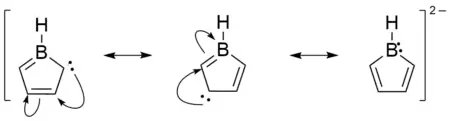
Příspěvky k celkové struktuře jsou zleva doprava 30,30 %, 30,71 % a 13,04 %. Analýzy byly provedeny u struktury [C4BH5]2− a optimalizovány s využitím BP86-D3BJ a def2- TZVPP.
Protože je borol isoelektronový s cyklopentadienylovým aniontem, tak by aromatická delokalizace měla způsobit přizpůsobení délek vazeb v BC4 řetězci. Tento předpoklad byl potvrzen u několika zkoumaných struktur, konkrétně u K2[PhBC4Ph4], K2[(4-Me3Si-C6H4)BC4Ph4] a K2[ClBC4Ph4]. Pozorované délky vazeb B–C jsou tak nízké (1,505 až 1,543 Å) a délky všech vazeb C–C se podobají (1,409–1,456 Å).[8][9][7]
Příprava
Prvním izolovaným derivátem borolu byl v roce 1969 pentafenylborol [PhBC4Ph4], tmavě modrá pevná látka.[10]
Přípravu [PhBC4Ph4] (1) byla prováděna dvěma různými způsoby:[10][7][11]
(a) přímou reakcí 1,4-dilithio-1,2,3,4-tetrafenylbutadienu s PhBBr2 za vzniku aduktu pentafenylborolu s Lewisovou zásadou (1·OEt2) v diethyletheru a následným odstraněním rozpouštědla (b) Výměnou boru s cínem mezi deriváty 2,3,4,5-tetrafenylstannolu a PhBCl2.[12]
Druhý postup lze použít i na přípravu dalších derivátů borolu.
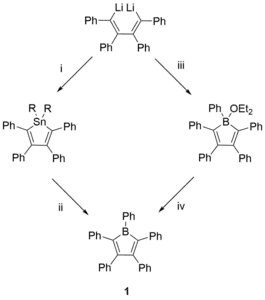
Nejčastěji se používá bor–cínová výměna, která může sloužit na přípravu mnoha různých derivátů borolu. První postup měl význam v rozvoji borolové chemie.
Mimo vývoj syntézy perfluorovaných obdob látky 1[13] jsou substituenty na BC4 jádrech stále většinou omezené na fenylové skupiny. Na atom boru se ovšem dá navázat i řada jiných substituentů, jako jsou halogenidy, aryly, a aminové skupiny. Podařilo se také navázat fragmenty ferrocenylových, cymantrenylových a platinových komplexů.
Elektronová hustota na atomu boru se liší v závislosti na něm navázaném substituentu. Substituenty tak mohou mít velký vliv na spektroskopické vlastnosti celého borolu; například silné π interakce způsobované dusíkem u [(Me3Si)2NBC4Ph4][14] zvyšují energii LUMO a modrý posun nejnižší energie absorpce v ultrafialovo-viditelném spektru (λmax = 478 nm) oproti [PhBC4Ph4] (λmax = 560 nm).
Za účelem získání méně stericky zatížených borolů byl vyvinut zirkonacyklový přenos.[15][16]
U reakce [Cp2ZrC4Me4] s PhBCl2 se předpokládal vznik [PhBC4Me4], produkt byl ovšem příliš reaktivní a izolován byl pouze jeho Dielsův–Alderův dimer. Pomocí experimentů s but-2-ynem a studií reaktivity u řady neaktivovaných alkenových meziproduktů byl pozorován [PhBC4Me4] před dimerizací.
V roce 2018 se podařilo přeměnit borapyramidan na stabilní halogenovaný borolový; stabilizován byl pomocí lithných kationtů umístěných nad a pod rovinou borolového kruhu,[17] čímž byla otevřena cesta k přímé syntéze boroldiidů z borapyramidanů.[18]
Reakce
Pentafenylborol má díky antiaromaticitě a vysoké Lewisovské kyselosti široké možnosti reaktivity.
Adukty s Lewisovými zásadami
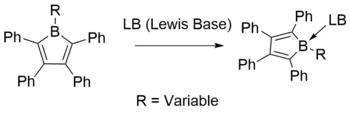
Vysoká Lewisovská kyselost způsobuje, že boroly vytvářejí adukty s mnoha různými Lewisovsky zásaditými donory. Tato reaktivita se používá jako ukázka antiaromatické povahy borolů.[10][19][20]
Na nenasycená borová centra se podařilo navázat pyridiny, ethery, fosfiny a karbeny.[21][22][23]
Takovéto reakce se většinou provádějí snadno a jejich průběh je kvantitativní, což umožňuje izolovat produkty s vysokou výtěžností. Při koordinaci s Lewisovou zásadou se původně prázdný orbital p stane obsazeným, což znemožní cyklickou delokalizaci π elektronů a ztrátu antiaromaticity. Střídání délek vazeb v BC4 ovšem zůstává zachováno a těmito elektronovými změnami je téměř nedotknuté. Spektroskopická měření jsou však na adukt mnohem citlivější. Na rozdíl od silně modře zabarvených borolových prekurzorů jsou tyto adukty světle žluté a mají ultrafialovo-viditelné excitace při λmax = 350–380 nm, což odpovídá zvětšení rozdílu energií mezi HOMO a LUMO.
Adiční reakce s nenasycenými uhlíkatými sloučeninami
Protože mají v rovinném π systému pouze 4 elektrony, tak jsou boroly značně destabilizovány a vykazují tak vysokou reaktivitu, což je projevuje například při dimerizacích[24] a cykloadicích.[25]
Z tohoto důvodu mohou být stabilní boroly připraveny pouze s využitím objemných substituentů navázaných na BC4 jádro.

Malý rozdíl energií HOMO a LUMO u borolů je činí vhodnými pro Dielsovy–Alderovy reakce. John J. Eisch popsal reakci [PhBC4Ph4] (1) s difenylacetylenem za vzniku aromatického heptafenylborepinu.[26]
Warren E. Piers obnovil zájem o tento druh reakce, když zkoumal reaktivitu perfluorované sloučeniny [PhBC4Ph4] (2 na obrázku výše) s alkyny.[27]
Významnou otázkou v této oblasti bylo, zda zvýšená Lewisovská kyselost 2 oproti 1 ovlivňuje reaktivitu této sloučeniny a jestli vytváří nové mechanismy reaktivity. Sloučenina 2 reagovala s třemi různě substituovanými alkyny s výrazně odlišnými elektronovými vlastnostmi, konkrétně šlo o C6F5)CC(C6F5, C6H5)CC(C6H5 a Et–CC–Et.
Reakce s na elektrony chudým C6F5)CC(C6F5 vyžadovala tvrdší reakční podmínky (110 °C, 7 dnů) a pozorován byl pouze předpokládaný Dielsův–Alderův produkt (3), jehož tvorba probíhá podobným mechanismem jako u 5. Stejný mechanismus byl také nalezen u Et–CC–Et (hex-3-ynu). Mírné reakční podmínky (samovolný průběh za pokojové teploty) ovšem umožnil izolaci přímého produktu Dielsovy–Alderovy cykloadice, 1,2-Et2-4, který je považován za termodynamicky upřednostňovaný ze dvou možných izomerů 7-borabicyklo[2.2.1]heptadienů. Delším zahříváním roztoků 4 vznikalo několik produktů, přičemž u některých bylo na základě 11B NMR spektroskopie zjištěno, že jde o borepinové izomery Et2-5 . Tím byly získány experimentální důkazy podporující navržený mechanismus tvorby borepinů z borolů a alkynů.
Reakce 2 s difenylacetylenem měla však neočekávané výsledky. Podobně jako u hex-3-ynu byla reakce na elektrony bohatého PhCCPh samovolná. Difenylované heptaarylborepiny 6 Dieslovou–Alderovou reakcí ovšem byly jen menšinovými produkty (25 %). Lewisovská kyselost 12 vyvolala jinou reakci, kde se alkyn nejprve nukleofilně navázal na borol, po čemž došlo k přesunu arylu a rozšíření kruhu za vzniku boracyklohexadienu 7 jako hlavního produktu (75 %).
Obě reakce probíhají vedle sebe a vlastnosti alkynu (především nukleofilita a substituenty) výrazně určují, který mechanismus bude převládat.
Rozšiřování kruhu
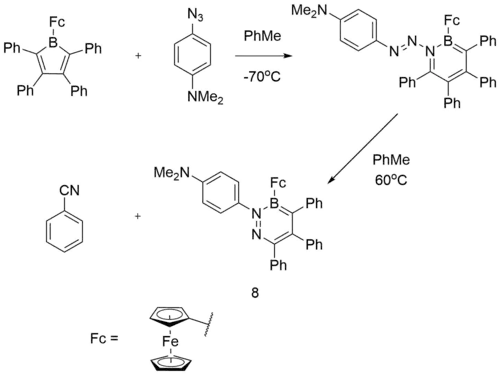
Vysoká reaktivita borolů také umožňuje jejich zapojení do rozšiřování cyklů[28] reakcemi s azidy.[29]
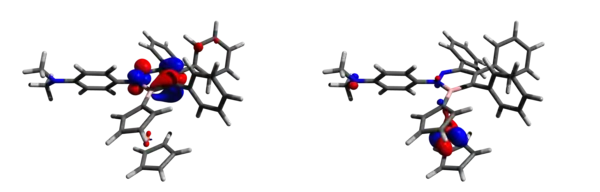
Při reakci 1‐(2,3,4,5‐tetrafenylborolyl)ferrocenu[4] s 4‐azido‐N,N‐dimethylanilinem vznikla nová sloučenina (8 na obrázku výše). Pomocí cyklické voltametrie bylo zjištěno, že 1,2,3‐diazaborinin vytváří podobné elektronové efekty jako pyridin, v důsledku čehož 8 slabě odtahuje elektrony. Analýzou hraničních molekulových orbitalů pomocí teorie funkcionálu hustoty bylo zjištěno, že HOMO obsahuje především orbital dx2-y2 z železa a LUMO se převážně nachází v BN pyridinovém kruhu, kde tvoří protivazebný π* orbital. Protože 8 má dva nukleofilní volné elektronové páry na dusíku, tak byly provedeny i výpočty nábojů na dusíku a k určení toho, který z nich je reaktivnější. Bylo zjištěno, že částečný náboj na pyridinovém dusíku je −0 232 V, zatímco u dimethylaminu činí −0,446 V, což ukazuje na větší hromadění elektronové hustoty u dimethylaminu, který je tak reaktivnějším nukleofilem.
Aktivace H2 bez použití kovů
Na základě studií frustrovaných Lewisových párů bylo zkoumáno, jestli způsobuje silná elektrofilita antiaromatických borolů podobnou reaktivitu.
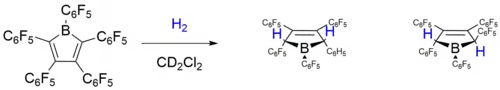
V roce 2010 popsali Warren E. Piers et al. aktivaci divodíku bez použití kovů pomocí [PhBC4Ph4] a jeho perfluorovaného analogu.[30]
Tyto studie byly původně zaměřeny na perfluorovanou variantu ([PhBC4Ph4]), protože jde o mimořádně silnou Lewisovu kyselinu, která lehce reaguje s H2 jak v roztoku, tak i v pevném skupenství, přičemž vytváří dva výše zobrazené izomery. Výpočty podle teorie funkcionálu hustoty se zjistilo, že trans-produkt je termodynamicky o 26 kJ/mol výhodnější; za tepelných podmínek ovšem žádná vzájemná přeměna izomerů nebyla pozorována. Pravděpodobný mechanismus reakce zahrbuje adukt borolu a H2, což bylo odvozeno z poměru vzniklých izomerů a z teoretických studieí. Autoři uvedli, že řídicí silou je pravděpodobně narušení antiaromaticity v borolovém kruhu jeho otevřením. I méně Lewisovsky kyselý borol 1 štěpil vazby H–H za tvorby podobných produktů (trans/cis: 1 : 4,3). Kombinace antiaromaticity a vysoké Lewisovské kyselosti dodává borolům schopnost aktivovat H2 bez přítomnosti kovů.
Sendvičové komplexy
Borolový dianion je izoelektronový s cyklopentadienidovým aniontem a tak může tvořit sendvičové sloučeniny ferrocenového typu[31] přostřednictvím η5 koordinace.
Boroly mohou vytvářet stabilní komplexy s dalšími prvky 13. skupiny, jako jsou hliník a gallium.[6]
Tyto komplexy byly získány reakcemi neutrálních substituovaných borolů s odpovídajícími komplexy kovů a Cp* v benzenu:
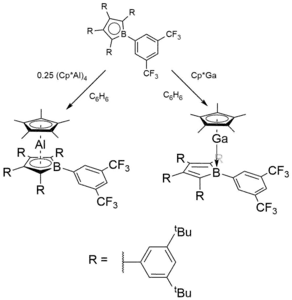
V komplexu hliníku je hlinitý kation zachycen mezi Cp*− a substituovaný boroldiidový dianion, což vytváří celkově neutrální strukturu. Christian P. Sindlinger[6] popsal průzkum orbitalů jednoduššího hypotetického komplexu (C4BH5)Al(C5H5, ve kterém zjistil, že má podobné vlastnosti jako plně substituovaná sloučenina. Úspěšný přesun dvou elektronů na borolový kruh byl potvrzen na základě toho, že na borolu založený HOMO byl téměř stejný jako LUMO u samotného borolu. Oxidace Al vykazuje Baderovy náboje +2,29 na Al a −0,78 borolu (C4B) jednotky. Tento náboj se ale nachází na butadienovém řetězci naproti atomu boru (Cβ −0,24; Cα −0,99; B +1,68). Náboj nahromaděný na centrální (C5)‐Cp* skupině, o hodnotě −1,17, je na pětici uhlíkových atomů rozdělen rovnoměrně. Topologickou analýzou pomocí kvantové teorie atomů v molekulách (QTAIM) se ukázala nepřítomnost kritického bodu mezi Al a B. Společně se silnou lokalizací elektronové hustoty na Cα byly kritické body nalezeny mezi Al a Cα (delokalizační index, DI, = 0,25), ne však mezi Al a Cβ (DI = 0,11).
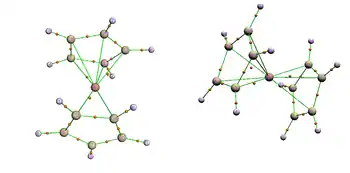
Galliový analog oproti tomu spíše tvoří adukty s Lewisovými zásadami skrze vazby Ga−B než neutrálním heteroleptickým mechanismes, jako hliník, což ukazuje, že si gallium drží oxidační číslo +1.[6]
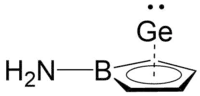
Byly popsány také polosendvičové struktury η5‐aminoborolového komplexu germanatých kationtů.[32]
Tholen et al. provedli výpočty na úrovni M06‐2X/Def2‐TZVP teorie funkcionálu hustoty a zjistili, že modelový komplex s daty získanými experimentálně pomocí rentgenové difrakce, s nejvyššími odchylkami ve vzdálenostech atomů a vazebných úhlech 1,6 % . U této sloučeniny byly spočítány její hraniční molekulové orbitaly a potvrzeny kovalentní vazby mezi vrcholovým atomem germania a borolovou základnou. HOMO se převážně nachází na atomu dusíku a vznikají HOMO‐1 a HOMO‐2 jako kombinace 4px a 4py orbitalů germania s π orbitaly borolového kruhu. HOMO‐3 je protivazebnou kombinací obsahující hlavně 4s a 4pz orbitaly germania a nejnižší π orbital borolu.
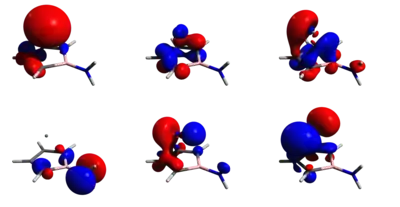
Analýzou přirozených vazeb byly objeveny významné orbitalové interakce mezi atomem germania a borolovou základnou, což naznačují Wibergovy indexy (WBI) vazby mezi uhlíkovými a borovými atomy v základně a atomem germania (od 0,31 do 0,42). Tyto hodnoty jsou podobné jako u germanatého komplexu Cp* kationtu (0,29) a mnohem větší než mezi lithnými ionty a atomy tvořícími borolový kruh u odpovídajícího sendvičového komplexu Li2[H2NBC4H4], v němž převažují iontové interakce (WBI (LiC) = WBI (LiB) = 0,02). Zatímco vypočtené rozdělení náboje u Li2[H2NBC4H4] obsahuje předpokládaný silný záporný náboj (−1,90 a.u.) na aminoborolové skupině, tak má stejná skupina mnohem menší náboj v komplexu s germaniem (−0,83 a.u.). Větší přesun náboje z aminoborolové jednotky na atom germania také způsobuje menší hodnoty Wibergových indexů oproti Li2[H2NBC4H4]. Společně s výpočty nevazebných orbitalů byla použita také analýza podle kvantové teorie atomů v molekulách (QTAIM), výsledkem byla klecovitá molekulární topologie u vzorové sloučeniny; vazby mezi atomy uhlíku v kruhu a germaniem jsou znázorněny na následujícím obrázku:
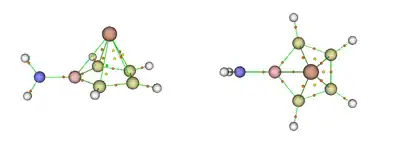
Další teoretické studie, také prováděné na úrovni M06-2X/Def2-TZVP, se zabývaly stabilitou polosendvičových komplexů C4H4BNH2 s ostatními prvky 14. skupiny (C, Si, Sn, Pb),[17] ve kterých se borolové jádro váže na dvojvazný kovový kation za tvorby η5 struktur.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Borole na anglické Wikipedii.
- Advances in Heterocyclic Chemistry. Redakce Alan R. Katritzky. [s.l.]: Academic Press, 1993. ISBN 978-0-12-020756-5. S. 375. (anglicky)
- Gerhard E. Herberich; Ulli Englert; Martin Hostalek; Ralf Laven. Derivate des Borols, XVI Bis(borol)nickel-Komplexe2). Chemische Berichte. 1991, s. 17–23. ISSN 1099-0682. DOI 10.1002/cber.19911240104.
- Holger Braunschweig; Thomas Kupfer. Recent developments in the chemistry of antiaromatic boroles. Chemical Communications. 2011-09-27, s. 10903–10914. ISSN 1364-548X. DOI 10.1039/C1CC13071D. PMID 21735004.
- Holger Braunschweig; Israel Fernández; Gernot Frenking; Thomas Kupfer. Structural Evidence for Antiaromaticity in Free Boroles. Angewandte Chemie International Edition. 2008, s. 1951–1954. ISSN 1521-3773. DOI 10.1002/anie.200704771. PMID 18228230.
- Po-Kam Lo; Kai-Chung Lau. High-Level ab Initio Predictions for the Ionization Energies and Heats of Formation of Five-Membered-Ring Molecules: Thiophene, Furan, Pyrrole, 1,3-Cyclopentadiene, and Borole, C4H4X/C4H4X+ (X = S, O, NH, CH2, and BH). The Journal of Physical Chemistry A. 2011-02-10, s. 932–939. ISSN 1089-5639. DOI 10.1021/jp110499c. PMID 21210670. Bibcode 2011JPCA..115..932L.
- Christian P. Sindlinger; Paul Niklas Ruth. A Neutral "Aluminocene" Sandwich Complex: η1- versus η5-Coordination Modes of a Pentaarylborole with ECp* (E=Al, Ga; Cp*=C5Me5). Angewandte Chemie International Edition. 2019, s. 15051–15056. ISSN 1521-3773. DOI 10.1002/anie.201907749. PMID 31390132.
- G. E. Herberich; B. Buller; B. Hessner; W. Oschmann. Derivative des borols: II. Pentaphenylborol: Synthese, reduktion zum dianion und komplexe von kobalt und platin. Journal of Organometallic Chemistry. 1980-08-26, s. 253–259. ISSN 0022-328X. DOI 10.1016/S0022-328X(00)93308-4.
- SO, Cheuk-Wai; WATANABE, Daisuke; WAKAMIYA, Atsushi; YAMAGUCHI, Shigehiro. Synthesis and Structural Characterization of Pentaarylboroles and Their Dianions. Organometallics. 2008-07-01, s. 3496–3501. ISSN 0276-7333. DOI 10.1021/om8002812. (anglicky)
- BRAUNSCHWEIG, Holger; CHIU, Ching-Wen; WAHLER, Johannes; RADACKI, Krzysztof; KUPFER, Thomas. Chemical Reduction and Dimerization of 1-Chloro-2,3,4,5-tetraphenylborole. Chemistry – A European Journal. 2010, s. 12229–12233. ISSN 1521-3765. DOI 10.1002/chem.201001556. PMID 20839188. (anglicky)
- John J. Eisch; Nalini K. Hota; Sinpei Kozima. Synthesis of pentaphenylborole, a potentially antiaromatic system. The Journal of the American Chemical Society. 1969-07-01, s. 4575–4577. ISSN 0002-7863. DOI 10.1021/ja01044a059.
- John J. Eisch; James E. Galle; Sinpei Kozima. Bora-aromatic systems. Part 8. The physical and chemical consequences of cyclic conjugation in boracyclopolyenes. The antiaromatic character of pentaarylboroles. Journal of the American Chemical Society. 1986-02-01, s. 379–385. ISSN 0002-7863. DOI 10.1021/ja00263a006. PMID 22175451.
- Advances in Heterocyclic Chemistry. Příprava vydání Francis Gordon Albert Stone, Robert West. [s.l.]: Academic Press, 1996. Dostupné online. ISBN 978-0-12-031139-2. S. 380.
- Cheng Fan; Warren E. Piers; Masood Parvez. Perfluoropentaphenylborole. Angewandte Chemie International Edition. 2009, s. 2955–2958. ISSN 1521-3773. DOI 10.1002/anie.200805865. PMID 19145617.
- Holger Braunschweig; Thomas Kupfer. Direct functionalization at the boron center of antiaromatic chloroborole. Chemical Communications. 2008-09-18, s. 4487–4489. Dostupné online. ISSN 1364-548X. DOI 10.1039/B808483A. PMID 18802599.
- Paul J. Fagan; Elizabeth G. Burns; Joseph C. Calabrese. Synthesis of boroles and their use in low-temperature Diels-Alder reactions with unactivated alkenes. Journal of the American Chemical Society. 1988-04-27, s. 2979–2981. ISSN 0002-7863. DOI 10.1021/ja00217a053.
- Paul J. Fagan; William A. Nugent; Joseph C. Calabrese. Metallacycle Transfer from Zirconium to Main Group Elements: A Versatile Synthesis of Heterocycles. Journal of the American Chemical Society. 1994-03-01, s. 1880–1889. ISSN 0002-7863. DOI 10.1021/ja00084a031.
- Shahnaz S. Rohman; Chayanika Kashyap; Sabnam S. Ullah; Ankur K. Guha. Viability of half sandwich complexes of borole with group 14 (II) ions: Structure, stability and reactivity. Polyhedron. 2019-09-15, s. 1–6. ISSN 0277-5387. DOI 10.1016/j.poly.2019.05.023.
- Vladimir Ya. Lee; Haruka Sugasawa; Olga A. Gapurenko; Ruslan M. Minyaev; Vladimir I. Minkin; Heinz Gornitzka; Akira Sekiguchi. From Borapyramidane to Borole Dianion. Journal of the American Chemical Society. 2018-05-16, s. 6053–6056. ISSN 0002-7863. DOI 10.1021/jacs.8b03473. PMID 29669416.
- Gerhard E. Herberich; Martin Hostalek; Ralf Laven; Roland Boese. Borole Dianions: Metalation of 1-(Dialkylamino)-2,5-dihydro-lH-boroles and the Structure of Li2 (C4 H4 BNEt2)·TMEDA. Angewandte Chemie International Edition in English. 1990, s. 317–318. ISSN 1521-3773. DOI 10.1002/anie.199003171.
- Gerhard E. Herberich; Michael Negele; Holger Ohst. Derivate des Borols, XVII η5-[1-(Diisopropylamino)borol]metall-Komplexe: Synthesen, Protonierung, interne Rotation. Chemische Berichte. 1991, s. 25–29. ISSN 1099-0682. DOI 10.1002/cber.19911240105.
- Holger Braunschweig; Ching-Wen Chiu; Krzysztof Radacki; Peter Brenner. Platinum substituted boroles. Chemical Communications. 2010-01-25, s. 916–918. ISSN 1364-548X. DOI 10.1039/B923652J. PMID 20107649.
- Holger Braunschweig; Alexander Damme; Daniela Gamon; Thomas Kupfer; Krzysztof Radacki. Synthesis and Coordination Chemistry of 1-Cymantrenyl-2,3,4,5-tetraphenylborole. Inorganic Chemistry. 2011-05-16, s. 4250–4252. ISSN 0020-1669. DOI 10.1021/ic200559d. PMID 21506525.
- Kay Ansorg; Holger Braunschweig; Ching-Wen Chiu; Bernd Engels; Daniela Gamon; Markus Hügel; Thomas Kupfer. The Pentaphenylborole–2,6-Lutidine Adduct: A System with Unusual Thermochromic and Photochromic Properties. Angewandte Chemie International Edition. 2011, s. 2833–2836. ISSN 1521-3773. DOI 10.1002/anie.201006234. PMID 21387499.
- Zheng Wang; Yu Zhou; Ka-Ho Lee; Wai Han Lam; Rian D. Dewhurst; Holger Braunschweig; Todd B. Marder. DFT Studies of Dimerization Reactions of Boroles. Chemistry – A European Journal. 2017, s. 11587–11597. ISSN 1521-3765. DOI 10.1002/chem.201701737. PMID 28627022.
- J. J. Baker; Khadilah H. M. Al Furaiji; O. Tara Liyanage; David J. D. Wilson; Jason L. Dutton; Caleb D. Martin. Diverse Reactivity of Dienes with Pentaphenylborole and 1-Phenyl-2,3,4,5-Tetramethylborole Dimer. Chemistry – A European Journal. 2019, s. 1581–1587. ISSN 1521-3765. DOI 10.1002/chem.201805151. PMID 30457687.
- John J. Eisch; James E. Galle; Babak Shafii; Arnold L. Rheingold. Bora-aromatic systems. 12. Thermal generation and transformation of the borepin ring system: a paradigm of pericyclic processes. Organometallics. 1990-08-01, s. 2342–2349. ISSN 0276-7333. DOI 10.1021/om00158a035.
- Cheng Fan; Warren E. Piers; Masood Parvez; Robert McDonald. Divergent Reactivity of Perfluoropentaphenylborole with Alkynes. Organometallics. 2010-11-08, s. 5132–5139. ISSN 0276-7333. DOI 10.1021/om100334r.
- Xiaojun Su; J. J. Baker; Caleb D. Martin. Dimeric boroles: effective sources of monomeric boroles for heterocycle synthesis. Chemical Science. 2020, s. 126–131. ISSN 2041-6539. DOI 10.1039/C9SC04053F. PMID 32110363.
- Felix Lindl; Shujuan Lin; Ivo Krummenacher; Carsten Lenczyk; Andreas Stoy; Marcel Müller; Zhenyang Lin. 1,2,3-Diazaborinine: A BN Analogue of Pyridine Obtained by Ring Expansion of a Borole with an Organic Azide. Angewandte Chemie International Edition. 2019, s. 338–342. ISSN 1521-3773. DOI 10.1002/anie.201811601. PMID 30394650.
- Cheng Fan; Lauren G. Mercier; Warren E. Piers; Heikki M. Tuononen; Masood Parvez. Dihydrogen Activation by Antiaromatic Pentaarylboroles. Journal of the American Chemical Society. 2010-07-21, s. 9604–9606. ISSN 0002-7863. DOI 10.1021/ja105075h. PMID 20583845.
- Advances in Heterocyclic Chemistry. Příprava vydání Alan R. Katritzky. [s.l.]: Academic Press ISBN 978-0-12-020779-4. S. 169–170.
- Patrik Tholen; Zhaowen Dong; Marc Schmidtmann; Lena Albers; Thomas Müller. A Neutral η5-Aminoborole Complex of Germanium(II). Angewandte Chemie International Edition. 2018, s. 13319–13324. ISSN 1521-3773. DOI 10.1002/anie.201808271. PMID 30070743.