Kyselina peroctová
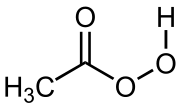
Kyselina peroctová (tiež kyselina peroxooctová, kyselina peroxyoctová, systematický názov kyselina peroxyetánová, PAA) je chemická zlúčenina zo skupiny organických peroxidov, sumárny vzorec CH3CO3H. Je to číra bezfarebná kvapalina s charakteristickým ostrým octovým zápachom. Má silný oxidačný potenciál a je silnou žieravinou.
| Kyselina peroctová | |||||||||||||||||||||||||||||||||||||||||
 Kyselina peroctová | |||||||||||||||||||||||||||||||||||||||||
 Kyselina peroctová | |||||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | C2H4O3 CH3COOOH | ||||||||||||||||||||||||||||||||||||||||
| Synonymá | Kyselina peroxooctová Kyselina peroxyoctová Kyselina peroxyetánová Acetylhydroperoxid | ||||||||||||||||||||||||||||||||||||||||
| Vzhľad | bezfarebná kvapalina | ||||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 76,1 u | ||||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 76,05 g/100 ml | ||||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 0,1 °C | ||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 105 °C | ||||||||||||||||||||||||||||||||||||||||
| Hustota | 1,13 g/cm³ | ||||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: neobmedzená | ||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 79-21-0 | ||||||||||||||||||||||||||||||||||||||||
| Číslo UN | 3105 | ||||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 201-186-8 | ||||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | SD8750000 | ||||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||||
Výroba
Kyselina peroctová sa vyrába nepretržitým pridávaním kyseliny octovej a peroxidu vodíka do vodného reakčného média obsahujúceho kyselinu sírovú ako katalyzátor. Reakcia sa necháva prebiehať až 10 dní (aby sa dosiahla vysoká výťažnosť produktu) podľa nasledujúcej rovnice:[1]:
- CH3COOH + H2O2 ↔ C2H4O3 + H2O
Kyselina peroctová sa vždy predáva ako roztok s kyselinou octovou a peroxidom vodíka, aby bola zaistená chemická stabilita. Koncentrácia kyseliny ako aktívnej zložky je rôzna, obvykle záleží na spôsobe použitia. Ďalšou metódou prípravy kyseliny je oxidáciou acetaldehydu alebo alternatívne môže ísť o cieľový produkt reakcie anhydridu kyseliny octovej, peroxidu vodíka a kyseliny sírovej. Iná metóda je založená na reakcii tetraacetyletyléndiamínu (TAED) za prítomnosti zásaditého roztoku peroxidu vodíka.[1] Kyselina peroctová prirodzene vzniká v životnom prostredí sériou fotochemických reakcií, zahŕňajúcich formaldehyd a fotooxidačné radikály.[2]
Použitie
Antimikrobiálne činidlo
Kyselina peroctová je ideálnym antimikrobiálnym činidlom, vďaka svojmu vysokému oxidačnému potenciálu. Je široko účinná proti mikroorganizmom a nie je deaktivovaná katalázou a peroxidázou, enzýmami rozkladajúcimi peroxid vodíka. Rozpadá sa na látky bezpečné pre potraviny i životné prostredie (kyselinu octovú a peroxid vodíka) a preto ju možno použiť pre bezoplachové aplikácie. Kyselina peroctová sa dá používať v širokom rozmedzí teplôt (0-40 °C), širokom rozmedzí pH(3,0 - 7,5), v procesoch clean-in-place (CIP, čistenie na mieste), v prostredí s tvrdou vodou, nie je ovplyvňovaná zvyškami bielkovín.
Mechanizmus účinku
Kyselina peroctová ničí mikroorganizmy oxidáciou (hydroxylovým radikálom (OH°)) a následným rozpadom ich bunkových membrán. Pretože je difúzia pomalšia než polčas života radikálu, reaguje s akoukoľvek oxidovateľnou zlúčeninou vo svojej blízkosti. Môže poškodiť takmer všetky typy makromolekúl spojených s mikroorganizmami: sacharidy, nukleové kyseliny (mutácia), lipidy (lipidová peroxidácia) a aminokyseliny (napr. konverziou fenylalanínu na m-Tyrozín a o-Tyrozín). To nakoniec vedie k lýze bunky a smrti mikroorganizmu.
Použitie
Americká organizácia EPA prvýkrát zaregistrovala kyselinu peroctovú ako antimikrobiálnu látku v roku 1985, a to pre použitie na tvrdé povrchy v interiéroch. Prípady použitia zahŕňajú napríklad poľnohospodárske objekty, výrobne potravín, zdravotnícke zariadenia a kúpeľne v domácnostiach. Kyselina peroctová je tiež registrovaná pre použitie v mliekarňach a syrárňach, pre zariadenia na výrobu potravín, pasterizéry v pivovaroch, vinárskych závodoch a ďalších výrobniach nápojov.[3] Používa sa tiež na dezinfekciu lekárskej techniky, ako prevencia tvorby biofilmu v papierňach, na čistenie a dezinfekciu vody. Kyselinu peroctovú je možné použiť i k dezinfekcii vody v chladiacich vežiach, kde bráni tvorbe biofilmu a umožňuje účinne bojovať s baktériou Legionelly.
V susednom Česku má použitie kyseliny peroctovej na dezinfekciu ešte oveľa dlhšiu históriu. Dezinfekčný prípravok Persteril sa vyrába od roku 1966, na trhu je rad ďalších prípravkov obsahujúcich kyselinu peroctovú. Prípravky s kyselinou peroctovou majú úplné spektrum dezinfekčnej účinnosti (A, B, C, T, M, V).[4].
Chemická syntéza
Kyselinu peroctovú možno použiť ako chemikáliu pre syntézu, kedy sa jej oxidačné vlastnosti využívajú k pridávaniu atómu kyslíka do dvojitých väzieb, napríklad v etyléne a propyléne, pre tvorbu epoxidov a alkoholov. Možno ju použiť aj pre syntézu glycerolu z propylénu, a tiež pri výrobe polyamidov.[5]
Bieliace činidlo
Kyselinu peroctovú je možné využiť aj ako bieliace činidlo. Pretože uvoľňuje kyslík výraznejšie a pri nižších teplotách než iné bielidlá, je jemnejšia k bieleným materiálom. Bielenie buničiny peroctovou kyselinou poskytuje papier, ktorý je úplne bez chlóru (označovaný TCF, angl. Totally Chlorine Free).
Bezpečnosť
Smrtiaca dávka (LD50) kyseliny peroctovej, je pre potkana (orálne) 1 740 mg/kg a pre králika (dermálne) 1 590 mg/kg.
Pozri aj
Referencie
- United States Department of Agriculture. Agriculture Marketing Service Peracetic acid. (PDF document).
- U.S. National Library of Medicine. Hazardous Substances Data Bank.
- U.S. Environmental Protection Agency. Hydrogen Peroxide and Peroxyacetic Acid.
- Dezinfekční prostriedok PERSTERIL®
- KEMI - Information on Substances. Peracetic Acid.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Kyselina peroctová na českej Wikipédii.








