Etán
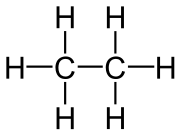
Etán je druhý najjednoduchší uhľovodík (v homologickom rade alkánov) po metáne. Jeho sumárny chemický vzorec je C2H6. Pri bežnom tlaku a teplote je to plyn bez farby a zápachu. Etán sa priemyselne izoluje zo zemného plynu a ako vedľajší produkt ropnej rafinácie. Najviac sa používa ako petrochemická surovina pri výrobe etylénu.
| Etán | |||||||||||||||||||||
 Etán | |||||||||||||||||||||
 Etán | |||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||
| Sumárny vzorec | C2H6 | ||||||||||||||||||||
| Synonymá | dimetyl, metylmetán, hydrid etylu | ||||||||||||||||||||
| Vzhľad | bezfarebný plyn | ||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||
| Molekulová hmotnosť | 30,07 | ||||||||||||||||||||
| Teplota topenia | −182,76 °C / 90,39°K | ||||||||||||||||||||
| Teplota varu | −88,6 °C / 184,55 °K | ||||||||||||||||||||
| Trojný bod | −182°C 11.10−6 bar | ||||||||||||||||||||
| Kritický bod | 32 °C 49 bar | ||||||||||||||||||||
| Hustota | 1,212 kg/m3 (plyn) | ||||||||||||||||||||
| Rozpustnosť | vo vode: 4,7 g/100 ml | ||||||||||||||||||||
| Teplota vzplanutia | −135 °C | ||||||||||||||||||||
| Medze výbušnosti | 3 % – 12,5 % | ||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||
| Skupenské teplo topenia | 0,583 kJ/mol | ||||||||||||||||||||
| Entropia topenia | 6,46 J/mol.K | ||||||||||||||||||||
| Skupenské teplo vyparovania | 10 kJ/mol | ||||||||||||||||||||
| |||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||
| Číslo CAS | 74-84-0 | ||||||||||||||||||||
| Vlastnosti | Nist WebBook | ||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||
Dejiny
Etán bol prvýkrát synteticky pripravený v roku 1834 Michaelom Faradayom, ktorý rozložil elektrolýzou octan draselný. Výsledný produkt tejto reakcie si ale pomýlil s metánom a ďalej ho už neskúmal. Počas rokov 1847 – 1849 v snahe potvrdiť teóriu radikálov v organickej chémii Hermann Kolbe a Edward Frankland vyrobili etán redukciami etylkyanidu a etyljodidu s draslíkom a tak, ako to robil Faraday, elektrolýzou vodných octanov. Títo si však zmýlili etán (dimér metylu) s metyl radikálom. Túto chybu opravil v 1864 Carl Schorlemmer, ktorý ukázal, že produktom všetkých týchto reakcií bol v skutočnosti etán.
Názov etánu pochádza z názvu éteru (vtedy názvu pre dietyléter).
Chemické vlastnosti
V laboratóriu môžeme etán jednoducho pripraviť Kolbeho elektrolýzou, kde elektrolyzujeme vodný roztok octanovej soli. Na anóde sa acetát oxiduje a vytvára sa oxid uhličitý a metylové radikály. Vysoko reaktívne metylové radikály sa spájajú (dimerizujú) na etán:
Iná metóda je oxidácia anhydridu kyseliny octovej peroxidmi, ktorá je konceptuálne veľmi podobná.
Chémia etánu taktiež zahŕňa hlavne reakcie voľných radikálov. Etán reaguje s halogénmi, predovšetkým s chlórom a brómom, halogenáciou voľnými radikálmi. Táto reakcia prebieha propagáciou etylového radikálu:
Pretože halogenizované etány sa môžu podrobiť ďalšej halogenácii voľnými radikálmi, tento proces vytvára zmes rôznych halogenizovaných produktov. V chemickom priemysle sa musia použiť selektívnejšie chemické reakcie na výrobu konkrétnych dvojuhlíkových uhľohalogénov.
Použitie
Hlavné využitie našiel etán v chemickom priemysle pri výrobe etylénu krakovaním parou. Keď sa uhľovodíky zmiešajú s parou a rýchlo zahrejú na veľkú teplotu (900 °C a viac), ťažké uhľovodíky sa lámu na ľahšie a nasýtené uhľovodíky sa menia na nenasýtené uhľovodíky. Etán sa preferuje pri výrobe etylénu, pretože krakovanie etánu je celkom selektívne na etylén, pokým krakovanie parou ťažších uhľovodíkov dáva zmes chudobnejšiu na etylén a bohatšiu na ťažšie alkény ako napríklad propylén a butadién, ale aj na arény.
Experimentálne sa etán podrobuje výskumu ako možná surovina pre iné chemikálie. Oxidačná chlorácia etánu sa dlho zdá ako ekonomicky vhodnejšia cesta k výrobe vinylchloridu ako chlorácia etylénu. Veľa technologických procesov sa už patentovalo na túto výrobu, ale nízka selektivita vinylchloridu a korozívne podmienky reakcie (používa sa zmes obsahujúca kyselinu chlorovodíkovú pri teplotách vyšších ako 500°C) predstavujú stále prekážky pri uvedení do praxe. V súčasnosti INEOS má v prevádzke pilotné zariadenie na výrobu vinylchloridu z etánu s kapacitou 1000 ton ročne vo Wilhemshavene v Nemecku.
Podobne saudskoarabská spoločnosť SABIC oznámila vybudovanie zariadenia na výrobu kyseliny octovej oxidáciou etánu s kapacitou 30 000 ton ročne v Yanbu. Ekonomická výhodnosť takéhoto procesu môže byť ale závislá na nízkej cene etán blízko saudskoarabských ropných polí a nemusí byť už taká konkurencieschopná s karbonyláciou metanolu inde na svete.
Etán sa môže použiť aj ako chladivo v kryogenických chladiacich systémoch. V oveľa menšej miere sa používa vo vedeckom výskume kvapalný etán na vitrifikáciu vzoriek obsahujúcich vodu na elektrónový mikroskop. Tenký film vody rýchlo ponorený do kvapalného etán pri -150°C alebo menej zamrzne rýchlejšie, ako stihne voda skryštalizovať. Takéto rapídne zmrazenie neporuší štruktúru mäkkých materiálov nachádzajúcich sa v kvapalnom stave, ako by ju porušili ľadové kryštály.



