Organický peroxid
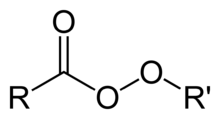
Organické peroxidy sú organické zlúčeniny obsahujúce peroxidovú funkčnú skupinu (ROOR'). Ak je R' vodík, zlúčenina sa nazýva organický hydroperoxid. Perestery majú všeobecnú štruktúru RC (O) OOR.
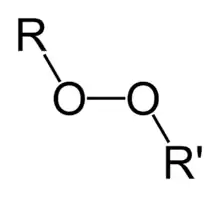
Väzba OO sa ľahko rozpadá a tvorí voľné radikály v podobe RO•. Preto sú organické peroxidy užitočné ako iniciátory niektorých druhov polymerizácie, napríklad u epoxidových živíc použitých na sklolamináty. Na tento účel sa zvyčajne používajú MEKP a benzoylperoxid. Uvedené vlastnosti však tiež znamenajú, že organické peroxidy môžu zámerne alebo nechtiac iniciovať explozívnu polymerizáciu látok s nenasýtenými chemickými väzbami - tento proces sa využíva vo výbušninách.
Väčšina organických peroxidov sú vysoko horľavé a výbušné látky, často reaktívne a prchavé. Už 5 mg dietyléterperoxidu môže roztrieštiť sklenenú chemickú súpravu. Organické peroxidy, podobne ako ich anorganické obdoby, sú účinnými bielidlami.
Syntéza
Peroxidy je možné syntetizovať v laboratóriu radom rôznych ciest:
- peroxykyseliny oxidáciou karboxylových kyselín peroxidom vodíka
- peroxokyseliny oxidáciou a hydrolýzou Grignardových reagencií
- peroxidy fotooxidáciou diénov
- peroxidy oxymerkuráciou alkénov s následnou reakciou s hydroperoxidmi
- peroxykyseliny reakciou alkylhalogenidov s peroxidom vodíka
Reakcia
Niektoré peroxidové reakcie sú:
- organická redukcia na alkoholy hydridom lítia a hliníka alebo estermi kyseliny fosforitej
- štiepenie na ketóny a alkoholy v zásadou katalyzovanom Kornblum-DeLaMareovom prešmyku
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Organický peroxid na českej Wikipédii.