Kyselina jablčná
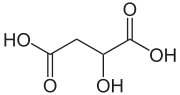
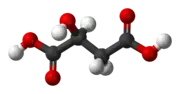
Kyselina jablčná, (C2H4O(COOH)2) je dikarboxylová kyselina, ktorú vyrábajú všetky živé organizmy, prispieva k príjemnej kyslej chuti ovocia, a je používaná ako prídavná látka v potravinách. Soli a estery kyseliny jablčnej sa nazývajú jablčnany (maláty).
| Kyselina jablčná | |||||||||||||||||||||||||||||||
 Kyselina jablčná | |||||||||||||||||||||||||||||||
 Kyselina jablčná | |||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||
| Sumárny vzorec | C4H6O5 | ||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná kryštalická látka | ||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 134,1 u | ||||||||||||||||||||||||||||||
| Molárna hmotnosť | 134,09 g/mol | ||||||||||||||||||||||||||||||
| Teplota topenia | 101 – 104 °C (D- alebo L-izomér) 128 – 132 °C (racemát) | ||||||||||||||||||||||||||||||
| Teplota rozkladu | 140 °C (L-izomér) | ||||||||||||||||||||||||||||||
| Hustota | 1,609 g/cm³ | ||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 16 g/100 ml (D- alebo L-izomér pri 20 °C) 55,8 g/100 ml (racemát pri 20 °C) v polárnych rozpúšťadlách: etanol 36,35 g/100 ml (D- alebo L-izomér pri 20 °C) 45,53 g/100 ml (racemát pri 20 °C) acetón éter mierne rozpustný | ||||||||||||||||||||||||||||||
| Teplota vzplanutia | 203 °C (racemát) | ||||||||||||||||||||||||||||||
| Teplota vznietenia | 349 °C (racemát) | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||
| Číslo CAS | 6915-15-7 | ||||||||||||||||||||||||||||||
| EINECS číslo | 230-022-8 | ||||||||||||||||||||||||||||||
| Číslo RTECS | ON7175000 | ||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||
Vlastnosti
Kyselina L-jablčná je prirodzene sa vyskytujúca forma, kým zmes L- a D- kyseliny jablčnej sa vyrába synteticky.
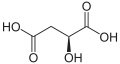 Kyselina L-jablčná
Kyselina L-jablčná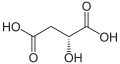 Kyselina D-jablčná
Kyselina D-jablčná Racemát
Racemát
Kyselina hrá dôležitú úlohu v biochémii. V Hatchov-Slackovom cykle je malát zdrojom CO2 v Calvinovom cykle. V citrátovom cykle je (S)-jablčnan intermediát tvorený pridaním –OH.
Je tiež systemizovaná karboxyláciou s fosfoenolpyruvátom v strážnych bunkách listov rastlín. Jablčnan, ako dvojitý anión, často sprevádza draslíkové katióny pri príjme rozpustených látok do bunky, aby bola zachovaná rovnováha elektrolytov v bunkách.
História
Kyselina jablčná bola prvýkrát izolovaná z jablčnej šťavy Carlom Wilhelmom Scheeleom v roku 1785. Kyselina jablčná prispieva ku kyslosti zeleného jablka. Je prítomná v hrozne a vo väčšine vín s koncentráciou niekedy až 5 g/l. Vytvára kyslastú chuť vína, aj keď jej obsah s rastúcou zrelosťou ovocia klesá. Proces jablčno – mliečneho kvasenia, premieňa na kyselinu jablčnú oveľa slabšiu kyselinu mliečnu.
Použitie
V potravinárstve
Kyselina jablčná sa používa v potravinárskom priemysle (býva označovaná ako prídavná látka E296) na dochucovanie. Je zdrojom extrémnej kyslosti cukroviniek, vyrábaných v USA, tzv. extrémnych cukroviniek. Je tiež používaná s menej kyslou kyselinou citrónovou v kyslých cukríkoch, ktoré sú niekedy označované upozornením, že nadmerná konzumácia môže spôsobiť podráždenie úst.
Výroba a hlavné reakcie
Kyselina jablčná je produkovaná priemyselne, je vyrábaná dvojitou hydratáciou maleínanhydridu. Bola dôležitá pri objave Waldenovej inverzie a Waldenovho cyklu.
Externý odkaz
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Malic acid na anglickej Wikipédii.

