Ester (chemická zlúčenina)
Estery sú skupina zlúčenín, v ktorých organická skupina nahrádza disociovateľný atóm vodíka v kyslíkatej kyseline.
Fyzikálne vlastnosti a charakteristika
Estery sú viac polárne než étery, no menej polárne než alkoholy. Zúčastňujú sa na tvorbe vodíkových mostíkov, ako akceptory, no nemôžu sa správať ako donory vodíkovej väzby. Táto schopnosť, vytvárať vodíkové mostíky, im dáva schopnosť rozpúšťať sa vo vode. Čím má ester viac uhlíkov, tým bude menej rozpustný vo vode. Pretože nie sú donormi, nemôžu sa spájať ani medzi sebou. Estery sú viac nestále, než karboxylové kyseliny, rovnakej molekulovej hmotnosti.
Estery organických kyselín
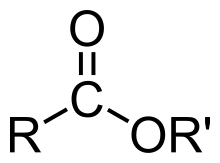
Estery karboxylových kyselín
Sú odvodené od karboxylových kyselín a majú vnútromolekulovú skupinu R-CO-O-R'. Najbežnejší spôsob ich prípravy je reakcia karboxylovej kyseliny s alkoholom, táto reakcia sa nazýva esterifikácia.
Príkladom môže byť esterifikácia kyseliny octovej metanolom za vzniku metylesteru kyseliny octovej (metylacetát, octan metylový):
- CH3-COO−H+ + HO-CH3 → CH3-CO-O-CH3 + H2O
Estery karboxylových kyselín majú často príjemnú ovocnú vôňu a používajú sa ako prísady v potravinárskom priemysle, kde sa nazývajú esencie. Vyskytujú sa aj v prírode a sú zodpovedné za niektoré vône a príchute ovocia.
- rumová esencia - etylester kyseliny mravčej
- ananásová esencia - metylester kyseliny maslovej
- broskyňová esencia - etylester kyseliny maslovej
- hrušková esencia - etylester kyseliny octovej
Estery sa tiež používajú ako rozpúšťadlá a riedidlá lakov, lepidiel a živíc. Sú tiež východiskovou látkou pri výrobe plastov, napríklad plexiskla.
Estery iných kyselín
Estery vznikajú aj esterifikáciou iných derivátov, napríklad tiokarboxylových alebo selenokarboxylových kyselín:
Estery anorganických kyselín
| Chemický portál |