Jodid strieborný
Jodid strieborný (AgI) je žltá kryštalická látka, anorganická zlúčenina jódu a striebra. Používa sa pre svoju fotocitlivosť vo fotografii, ako antiseptikum v medicíne a pre umelé vyvolávanie dažďa a zakladanie oblakov. Jodid strieborný je prakticky nerozpustný vo vode a veľmi zle rozpustný aj v koncentrovanom roztoku amoniaku[1].
| Jodid strieborný | |||||||||||||||||||||||||||||||||||
 Jodid strieborný | |||||||||||||||||||||||||||||||||||
 Jodid strieborný | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | AgI | ||||||||||||||||||||||||||||||||||
| Vzhľad | žltá kryštalická látka | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 234,8 u | ||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 234,771 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | 554 °C | ||||||||||||||||||||||||||||||||||
| Teplota varu | 1 506 °C | ||||||||||||||||||||||||||||||||||
| Hustota | 5,674 g/cm3 (γ) 5,64 g/cm3 (β) 6,1 g/cm3 (α) | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 2,8•10-7 g/100 ml v polárnych rozpúšťadlách: roztok jodidu draselného roztoky tiosíranov roztoky kyainidov roztoky amonných soli (málo) | ||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||
| Entropia topenia | 40,1 J/g | ||||||||||||||||||||||||||||||||||
| Entropia varu | 478,3 J/g | ||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −61,9 kJ/mol (γ) | ||||||||||||||||||||||||||||||||||
| Štandardná entropia | 155,5 J K-1mol−1 (γ) | ||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −66,4 kJ/mol (γ) | ||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,243 J K−1 g−1 (γ) | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 7783-96-2 | ||||||||||||||||||||||||||||||||||
| Číslo UN | 3077 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 232-038-0 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
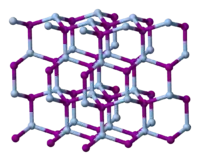
Kryštálová štruktúra jodidu strieborného sa s teplotou mení. Sú známe nasledujúce fázy[2]:
- Do teploty 420 K (147 °C) existuje jodid strieborný v β-fáze, čo je wurtzitová štruktúra. Je známy ako minerál jodargyrit.
- Nad 420 K podlieha premene na α-fázu, čo je objemovo centrovaná kubická štruktúra a strieborné ióny sú náhodne rozptýlené medzi koordinačné čísla 2, 3 a 4.
- Pri teplotách pod 420K existuje aj metastabilnej γ-fáze, majúcej sfaleritickú štruktúru. V prírode sa tejto podobe vyskytuje v podobe minerálu miersitu.
Použitie
Fotografia
Vo fotografii sa jodid strieborný začal prvýkrát využívať v technike daguerrotypia, patentované Louisom Daguerreom už vroku 1839. Fotografický obraz sa zaznamenával na dosku potiahnutú jodidom strieborným, pričom doba expozície trvala asi 15 až 20minút.
Vyvolávanie dažďa
Kryštálová štruktúra jodidu strieborného je podobná štruktúre ľadu, čo umožňuje vyvolávať mrznutie (heterogénnej nukleacii) pri zakladaní oblakov s cieľom umelo vyvolať dážď (kryštáliky pôsobia ako kondenzačné jadrá). Pre tento účel sa spotrebuje približne 50 ton jodidu strieborného ročne, z toho pri každom takomto experimente 10 až 50 gramov[3]. Táto metóda sa najviac používa v Číne alebo na Blízkom východe, napr. V Spojených arabských emirátoch.[4]
Jodid strieborný ako iónový vodič
Premena medzi formami alfa a beta predstavuje topenie striebornej (katiónovej) podmriežky. Entropia topenia pre α-jodid strieborný je približne polovičná oproti entropii chloridu sodného (typickej iónovej tuhej látke). To je možné racionalizovať zmienkou, že kryštálová mriežka jodidu strieborného je pri premene medzi formami α a β, zásadne čiastočne roztavená. Pridaním entropie premeny z α na β k entropii topenia sa získa hodnota, ktorá je oveľa bližšie entropii topenia chloridu sodného.
Referencie
- REMY, Heinrich. Anorganická chémie II. Praha : SNTL - Státní nakladatelství technické literatury, 1972. Dostupné online. Kapitola Stříbro. (po česky)
- BINNER, Jon G. P.; DIMITRAKIS, Georgios; PRICE, D. M., et al. Hysteresis in the β–α Phase Transition in Silver Iodide. Journal of Thermal Analysis and Calorimetry, 2006, roč. 84, s. 409–412. Dostupné online [PDF, cit. 2015-03-29]. DOI: 10.1007/s10973-005-7154-1. (po anglicky)
- Phyllis A. Lyday "Iodine and Iodine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- Arabští vyvolávači deště úspěšně používají jodid stříbrný. Hospodářské Noviny, 23. júla 2009. Dostupné online [cit. 2015-03-29]. (po česky)
Literatúra
- VOHLÍDAL, Jiří; JULÁK, Alois; ŠTULÍK, Karel. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5. (po česky)
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Jodid stříbrný na českej Wikipédii.


