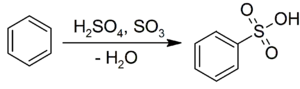Kyselina sírová
Kyselina sírová je silná minerálna, anorganická kyselina, miešateľná s vodou v neobmedzenom pomere. Kyselina sírová má veľmi veľa použití a po vode je to chemikália s najväčšou produkciou na svete, je takisto nazývaná aj "krvou chemického priemyslu", pretože sa nenájde výroba, kde by sa kyselina sírová nepoužívala. Dôležité aplikácie zahrňujú spracovanie rúd, výrobu hnojív, rafinovanie ropy, čistenie odpadových vôd a rôzne chemické syntézy.
| Kyselina sírová | |||||||||||||||||||||||||||||||||||
 Kyselina sírová | |||||||||||||||||||||||||||||||||||
 Kyselina sírová | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | H2SO4 | ||||||||||||||||||||||||||||||||||
| Synonymá | vitriol, vitriolový olej | ||||||||||||||||||||||||||||||||||
| Vzhľad | bezfarebná kvapalina bez zápachu | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 98,07948 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | 10,36 °C (283 K) | ||||||||||||||||||||||||||||||||||
| Teplota varu | 338 °C (611 K) | ||||||||||||||||||||||||||||||||||
| Hustota | 1,836 g/cm3 | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | neobmedzene miešateľná vo vode (silne exotermická reakcia!) | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 7664-93-9 | ||||||||||||||||||||||||||||||||||
| Číslo UN | 1830 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 231-639-5 | ||||||||||||||||||||||||||||||||||
| Číslo RTECS | WS5600000 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
Nesystémový názov vitriol pochádza z názvu minerálu zelený vitriol (FeSO4·7H2O), z ktorého sa v minulosti pripravovala.
Fyzikálne vlastnosti
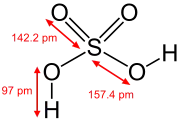
Čistá kyselina sírová je bezfarebná olejová kvapalina s hustotou 1,836 g/cm3 a teplotou topenia 10,36 °C. Pri každom pomere kyseliny sírovej a vody sa teplota tuhnutia mení. Tak vzniká diagram tuhnutia závislosti teploty tuhnutia od hmotnostného percentného obsahu kyseliny sírovej. Ide v podstate o štyri eutektické systémy medzi jednotlivými hydrátmi kyseliny sírovej (sústavy: H2O - H2SO4.4H2O, H2SO4.4H2O - H2SO4.2H2O, H2SO4.2H2O - H2SO4.H2O, H2SO4.H2O - H2SO4). Už aj malými množstvami vody sa teplota topenia znižuje (pri 96% kyseline sírovej je to len 3 °C). Do predaja prichádza ako 98% vodný roztok, nakoľko pri jej destilácii sa tvorí azeotropická zmes s vodou. Takáto kyselina sírová sa nazýva koncentrovaná.
Veľa proteínov sa pripravuje z aminokyselín obsahujúcich síru (napr. cysteín a metionín), ktoré sa metabolizujú na kyselinu sírovú.
Chemické vlastnosti
Pri rôznej koncentrácii kyseliny sírovej sa vyznačujú rôzne chemické vlastnosti. Vo veľkej koncentrácii sa prejavujú jej oxidačné účinky centrálneho atómu síry a v malej koncentrácii zasa jej kyslosť (resp. oxidačné účinky kyslého vodíka). V čistej kyseline sírovej nastáva jej autoprotolýza:
- H2SO4 + H2SO4 ↔ H3SO4+ + HSO4-
Riedenie kyseliny sírovej s vodou je prudko exotermická reakcia. V prípade, že sa leje voda do koncentrovanej kyseliny sírovej, môže roztok zovrieť a nebezpečne prskať. Vždy by sa mala liať kyselina do vody a nikdy nie naopak. Toto sa dá zapamätať mnemotechnickou pomôckou: "nelejeme Dunaj do kyseliny, ale kyselinu do Dunaja". Nutnosť tohto postupu vyplýva z relatívnych hustôt týchto kvapalín. Voda má menšiu hustotu ako kyselina sírová, a preto má tendenciu držať sa nad kyselinou. Riedenie si môžeme najlepšie predstaviť ako tvorbu hydroxóniových katiónov:
- H2SO4 + H2O → H3O+ + HSO4−,
a potom
- HSO4- + H2O → H3O+ + SO42−.
Pretože hydratácia kyseliny sírovej je termodynamicky veľmi priaznivá, kyselina sírová je excelentné dehydratačné činidlo. Pohlcuje aj vodnú paru zo vzduchu, preto ,keď ju necháme otvorenú, jej objem sa "paradoxne" zväčší. V laboratóriu sa používa ako vysušovadlo. Afinita kyseliny sírovej k vode je taká silná, že ju dokáže odoberať i naviazanú z iných látok, napríklad škrob (C6H12O6)n sa pôsobením kyselinou sírovou takmer okamžite rozkladá na elementárny uhlík a vodu, ktorá je ňou hneď absorbovaná (a tak sa mierne zriedi):
- (C6H12O6)n → 6C + 6H2O.
Následne reaguje uhlík s kyselinou sírovou za vzniku oxidu siričitého a oxidu uhličitého:
- C(s) + 2 H2SO4(l) → CO2(g) + 2 H2O(l) + 2 SO2(g)
Podobný výsledok môžeme vidieť, keď vylejeme koncentrovanú kyselinu sírovú na papier; škrob v papieri reaguje a papier vyzerá akoby bol spálený (sadze po spálenom papieri sú vlastne ten istý elementárny uhlík). Ešte dramatickejšia reakcia prebieha, keď sa kyselina sírová kvapne na lyžičku bieleho cukru; okamžite sa z neho stane iba čierny pórovitý uhlík páchnuci po karameli (pri hydratácii kyseliny sírovej sa uvoľní teplo, ktoré skaramelizuje ešte nezreagovaný cukor). Kyselina sírová podobne reaguje s mnohými inými organickými materiálmi vrátane kože, tkanív a textilu!
Ďalšie reakcie
Kyselina sírová vytvára s väčšinou zásad príslušné sírany. Napríklad, modrý síran meďnatý, používaný pri galvanickom pokovovaní a ako fungicíd, sa pripravuje reakciou oxidu meďnatého s kyselinou sírovou:
- CuO (s) + H2SO4 (aq) → CuSO4 (aq) + H2O (l)
Kyselina sírová sa tiež používa na vytesnenie slabších kyselín z ich solí, napríklad kyseliny octovej z octanu sodného:
- H2SO4 + CH3COONa → NaHSO4 + CH3COOH
Podobne môže byť pripravená kyselina dusičná z dusičnanu draselného. Ako druhý produkt vzniká hydrogensíran draselný. V kombinácii s kyselinou dusičnou pôsobí kyselina sírová ako dehydratačné činidlo, vytvárajúce nitrónium NO2+, ktoré je dôležité pri elektrofilných substitúciách aromatických zlúčenín. Koncentrovaná kyselina sírová reaguje s chloridom sodným:
- NaCl + H2SO4 → NaHSO4 + HCl
Kyselina sírová je veľmi reaktívna, reaguje skoro so všetkými kovmi okrem železa (v koncentrovanom stave ho pasivuje - vytvára ochrannú vrstvu oxidu), olova, zlata, platiny a wolfrámu, 20% vodný roztok nereaguje s meďou. Zriedená kyselina sírová rozpúšťa železo, hliník, zinok, mangán, horčík, nikel a iné kovy. Na rozpustenie medi a cínu je potrebná horúca koncentrovaná kyselina. Olovo a wolfrám sa nerozpúšťajú. Reakcia kyseliny so železom za vývoja vodíka je typická pre väčšinu kovov, ale pri rozpúšťaní cínu sa vyvíja oxid siričitý:
- Fe (s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
- Sn (s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O (l) + SO2 (g)
Tento rozdiel je spôsobený oxidačnými vlastnosťami koncentrovanej kyseliny pri rozpúšťaní cínu, medi, alebo zinku. V prípade aromatických zlúčenín, napríklad benzénu, prebieha elektrofilná substitúcia, pričom vzniká príslušná sulfónová kyselina:
Výroba
Kyselinu sírovú vyrábame zo síry, kyslíka a vody kontaktným procesom.
V prvom kroku sa spaľuje síru za vzniku oxidu siričitého:
Oxid siričitý sa následne kyslíkom oxiduje na oxid sírový v prítomnosti oxidu vanadičného ako katalyzátora:
- (2) 2 SO2 + O2(g) → 2 SO3(g) (katalyzátor V2O5)
Nakoniec sa oxid sírový nechá reagovať s vodou (zvyčajne nie s čistou, ale s 97-98% roztokom H2SO4 obsahujúcim 2-3% vody) za vytvorenia 98-99% kyseliny sírovej.
Oxid sírový sa z praktických dôvodov nerozpúšťa v čistej vode, pretože je to vysoko exotermická reakcia produkujúca žieravý aerosól namiesto roztoku. Alternatívne sa oxid sírový môže absorbovať do už vyrobenej kyseliny sírovej, čím vznikne tzv. óleum (H2S2O7), a to sa následne riedi vodou na kyselinu sírovú.
- (3) H2SO4(l) + SO3 → H2S2O7(l)
Óleum reaguje s vodou za vzniku koncentrovanej H2SO4:
- (4) H2S2O7(l) + H2O(l) → 2 H2SO4(l)
Zriedená kyselina sírová sa dá vyrobiť aj zmiešaním kyseliny siričitej s peroxidom vodíka
- (5) H2SO3(l) + H2O2(l) → H2SO4(l) + H2O(l)
V roku 2001 sa na celom svete vyrobilo viac ako 165 miliónov ton kyseliny sírovej.
Použitie
Použitie kyseliny sírovej je veľmi široké. Kyselina sírová sa používá najmä:
- pri výrobe priemyslových hnojív (superfosfát,...)
- pri výrobe chemikálií
- pri výrobe plastov
- pri výrobe liečiv
- pri výrobe farbív
- pri výrobe výbušnín
- v papierenskom priemysle
- v textilnom priemysle
- pri výrobe syntetických vláken
- pri úprave rúd
- pri spracovaní ropy
- ako náplň do olovených akumulátorov
- pri sušení a odvodňování látok (ak necháte otvorenú nádobu s kyselinou, tak po čase sa z nej nevyparí časť vody, ale naopak, objem kyseliny bude väčší, lebo kyselina pohltí vzdušnú vlhkosť)