Kyselina peroxosírová
Kyselina peroxosírová je jedna z dvoch peroxokyselín síry. V pevnom stave je to nestála bezfarebná kryštalická látka, ktorá sa teplom alebo pôsobením vzdušnej vlhkosti ľahko rozkladá. Jej nestály vodný roztok sa nazýva kyselina Caroova.
| Kyselina peroxosírová | |||||||||||||||||||
 Kyselina peroxosírová | |||||||||||||||||||
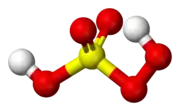 Kyselina peroxosírová | |||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||
| Sumárny vzorec | H2SO5 | ||||||||||||||||||
| Synonymá | Kyselina peroxomonosírová Kyselina persírová Kyselina permonosírová Caroova kyselina | ||||||||||||||||||
| Vzhľad | Nestála bezfarebná kryštalická látka | ||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||
| Molekulová hmotnosť | 114,08 u | ||||||||||||||||||
| Molárna hmotnosť | 114,0779 g/mol | ||||||||||||||||||
| Teplota rozkladu | 45 °C (čiastočne) | ||||||||||||||||||
| Hustota | 2,239 g/cm3 | ||||||||||||||||||
| |||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||
| Číslo CAS | 7722-86-3 | ||||||||||||||||||
| Číslo UN | 1483 | ||||||||||||||||||
| EINECS číslo | 231-766-6 | ||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||
Príprava
Čistú kyselinu peroxosírovú pripravíme rozpúšťaním oxidu sírového v peroxide vodíka
- SO3 + H2O2 → H2SO5
alebo reakciou kyseliny chlórsulfónovej s koncentrovaným peroxidom vodíka
- HSO3Cl + H2O2 → H2SO5 + HCl
alebo z kyseliny peroxodisírovej pôsobením vody
- H2S2O8 + H2O → H2SO5 + H2SO4.
Vodný roztok kyseliny peroxosírovej (kyselina Caroova) sa pripravuje v laboratóriu bezprostredne pred použitím zmiešaním kyseliny sírovej s peroxidom vodíka
- H2SO4 + H2O2 → H2SO5 + H2O
reakcia je silne exotermická, preto je nevyhnutná vysoká opatrnosť.
Vlastnosti
Kyselina peroxosírová vo svojej molekule obsahuje jednu peroxoskupinu -O-O-. Usporiadanie väzieb atómu síry ku kyslíkovým atómom si zachováva rovnakú tetraedrickú symetriu, ako má anión kyseliny sírovej SO42-, tzn. uhol medzi väzbami O-S-O je približne 109,5°.
S kyselinou chlórsulfónovou reaguje za vzniku kyseliny peroxodisírovej
- H2SO5 + HSO3Cl → H2S2O8 + HCl.
Kyselina peroxosírová patrí medzi veľmi silné kyseliny a súčasne je veľmi silným oxidačným činidlom, rovnako ako jej soli. V laboratóriu sa používa najmä jej kyslá draselná soľ, hydrogenperoxosíran draselný, KHSO5, ktorý je priemyselne vyrábaný a dodávaný ako trojný komplex s hydrogensíranom draselným (kyslý síran draselný) a normálnym síranom draselným 2KHSO5·KHSO4·K2SO4 pod obchodným názvom „Oxon“.
Kyselina peroxosírová sa s vodou neobmedzene mieša, ale ako kyselina samotná, tak jej soli, sa postupne vo vodnom roztoku rozkladajú za vzniku peroxidu vodíka, napr.
- H2SO5 + H2O → H2SO4 + H2O2
čo je podstatou jej oxidačného účinku.
Organické tioétery oxiduje dvojstupňovo najprv na sulfoxidy
- R1–S–R2 + H2SO5 → R1–SO–R2 + H2SO4
(R1 a R2 označuje dva rovnaké alebo rôzne alkylové radikály) a pri nadbytku oxidačného činidla až na sulfóny
- R1–SO–R2 + H2SO5 → R1–SO2–R2 + H2SO4.
Podobne možno oxidovať pôsobením tohto činidla terciárne amíny na aminoxidy
- R3N + H2SO5 → R3N–O + H2SO4
kde R3 značí tri rovnaké alebo rôzne alkylové radikály.
Použitie
Kyselina peroxosírová sa v laboratóriu aj v priemysle používa ako oxidačné činidlo. Pri príprave plastických hmôt polymerizáciou sa jej soli (amónne, sodné, draselné) používajú ako iniciačné činidlá. Ďalej sa kyselina používa ako dezinfekčné (napr. pri údržbe plaveckých bazénov, ale aj na čistenie zubných protéz) či bieliace činidlo (napr. v papierenskom priemysle na odstránenie lignínu z celulózy) a na odstraňovanie zápachov. Používa sa tiež pri likvidácii kyanidov, najmä v kaloch odpadajúcich pri extrakcii zlata z rúd.
Bezpečnosť
Kyselina peroxosírová má silne leptajúce účinky, preto pri práci s ňou je nutné používať ochranné prostriedky a zabrániť jej kontaktu s ľudským telom. Pri kontakte s horľavými látkami môže spôsobiť aj ich samovznietenie.
Historická poznámka
Kyselinu peroxosírovú objavil nemecký chemik Heinrich Caro na konci 19. storočia.
Táto kyselina sa tiež objavila v divadelnej hre Lijavec, kde fiktívny spoluautor hry Jára Cimrman považoval vzorec H2SO5 za dobrý vtip, ktorý musí pobaviť každého chemika.[1]
Referencie
- Ze života génia [online]. Cimrmanův zpravodaj. Dostupné online. (po česky)
Pozri aj
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Kyselina peroxosírová na českej Wikipédii.
