Hydrogenace
Hydrogenace (nebo také adice vodíku) je chemická reakce mezi molekulárním vodíkem H2 a další látkou (zpravidla nenasycenou) za přítomnosti katalyzátoru. Mezi nejčastější hydrogenace patří redukce násobných vazeb nebo jiných funkčních skupin v organických sloučeninách. Nejběžnějšími katalyzátory jsou například paladium, nikl nebo platina. Podle typu substrátu a katalyzátoru se hydrogenace provádí za různých teplot a tlaků. Vysoká teplota a tlak vedou k rychlejší adsorpci vodíku na povrchu katalyzátoru. Při velmi vysokých teplotách lze hydrogenaci provést i bez katalyzátoru.
Hydrogenace obvykle znamená adici dvou atomů vodíku do molekuly organické látky. Nejběžnější hydrogenací je navázání vodíku na dvojné a trojné vazby v uhlovodících, tedy na alkeny a alkyny[1]. Hydrogenace se proto používá k nasycení vazeb organických sloučenin.
Při většině hydrogenačních reakcích se používá plynný vodík (H2), některé reakce však využívají alternativní zdroje vodíku (transferová hydrogenace). Hydrogenační reakce, při kterých se po přidání vodíku poruší vazby, se nazývají hydrogenolýza. Jsou to například vazby uhlík-uhlík a uhlík-heteroatom (kyslík, dusík, halogen).
Katalytická hydrogenace byla poprvé provedena v roce 1890 francouzským chemikem Paulem Sabatierem, který za ni obdržel Nobelovu cenu. Na pokusech spolupracoval s Jeanem Baptistem Senderensem.
Obrácené reakci, tedy odstranění vodíku z molekuly, se říká dehydrogenace. Hydrogenace a dehydrogenace jsou reakce navzájem vratné. Obecně platí, že hydrogenace jsou reakce exotermní, zatímco dehydrogenace endotermní. Hydrogenace se liší od protonace a od hydridové adice, neboť při hydrogenaci má produkt stejný náboj jako reaktanty.
Princip hydrogenační katalýzy

Molekuly vodíku jsou velmi stabilní, neboť pro reakci H2 → 2H* se disociační entalpie ΔH0 rovná 434 kJ·mol−1. Proto je pro hydrogenaci obvykle nutný katalyzátor, nejčastěji kov. Molekula vodíku H2 se naváže na atom kovu a tím se oslabí vazba mezi atomy vodíku, které jsou pak schopné dále reagovat. Většina hydrogenačních katalyzátorů je schopna molekuly vodíku adsorbovat, disociovat a připravit tak velmi reaktivní atomy vodíku. Například heterogenní hydrogenaci dvojné vazby alkenu (C = C) na povrchu kovového katalyzátoru lze rozdělit do tří kroků:
- Reaktanty se adsorbují na povrchu katalyzátoru a H2 disociuje na dva atomy.
- Atom H se váže na jeden atom C. Druhý atom C je stále připojen k povrchu.
- Druhý atom C se váže na atom H a molekula opouští povrch.
Tato adice se nazývá syn-adice, neboť atomy vodíků přistupují ke dvojné vazbě ze stejné strany.
Aktivovat vodík mohou prakticky všechny přechodné kovy, které se snaží naplnit své neobsazené orbitaly elektrony od adsorbovaných molekul. Jako hydrogenační katalyzátory se používají tři skupiny látek:
- Kovy - palladium, platina, nikl, cobalt, měď, železo, jejich hydrogenační aktivita klesá v pořadí Pd > Pt > Ni = Co > Cu > Fe.
- Oxidy kovů - ZnO, Cr2O3, MoO3, WO3, jejich aktivita je mnohem nižší než u katalyzátorů kovových a přijatelných reakčních rychlostí se dociluje teprve při vysokých teplotách.
- Sulfidy - WS2, MoS2, NiS, jejich hydrogenační aktivita je také mnohem nižší než u kovových katalyzátorů.
Substráty a produkty hydrogenace
| Substrát | Výrobek | Komentáře | Hydrogenační
teplo (kJ/mol) |
|---|---|---|---|
| R2C = CR'2
(alken) |
R2CHCHR'2
(alkan) |
například výroba margarinu | −90 až −130 |
| RC≡CR"
(alkyn) |
RCH2-CH2R"
(alkan) |
semihydrogenace dává cis-RHC=CHR' | −300
(pro plnou hydrogenaci) |
| RCHO
(aldehyd) |
RCH2OH
(primární alkohol) |
často využívá transferovou hydrogenaci | −60 až −65 |
| R2CO
(keton) |
R2CHOH
(sekundární alkohol) |
často využívá transferovou hydrogenaci | −60 až −65 |
| RCO2
R' (ester) |
RCH2OH +
R'OH (dva alkoholy) |
například výroba mastných alkoholů | −25 až −105 |
| RCO2H
(karboxylová kyselina) |
RCH2OH
(primární alkohol) |
například výroba mastných alkoholů | −25 až −75 |
| RNO2
(nitro) |
RNH2
(amin) |
hlavní aplikací je anilin | −550 |
Využití hydrogenace
Hydrogenace se obvykle využívá k redukci nebo saturaci (nasycení) organických sloučenin. Velké využití nachází hydrogenace v petrochemickém, farmaceutickém a potravinářském průmyslu.
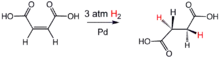
Velký průmyslový význam mají katalytické hydrogenace mastných kyselin (kalení tuků) při výrobě margarínu. Hydrogenací nenasycených mastných kyselin se snižuje počet dvojných vazeb v molekule. Tím dochází ke zvyšování bodu tání, tedy ke ztužování. Ilustrativním příkladem takové hydrogenační reakce je přidání vodíku ke kyselině maleinové, která obsahuje dvojnou vazbu. Adicí vodíku se dvojná vazba zruší a vzniká kyselina jantarová, která se používá jako barvivo, léčivo a ke změkčování plastů[2].
Některé cis konfigurace dvojných vazeb se při tom mohou změnit na konfigurace trans, čímž vznikají transmastné kyseliny, které jsou nezdravé. Úplnou hydrogenací se nenasycené mastné kyseliny mění v nasycené, kdy všechny dvojné vazby mezi atomy uhlíku zaniknou, tedy včetně trans konfigurací. Toho využívá moderní proces částečného ztužování zvaný interesterifikace, při kterém dochází k výměně mastných kyselin mezi molekulami přírodních a zcela nasycených tuků, takže produkci trans izomerů je zabráněno.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Hydrogenation na anglické Wikipedii a Hydrierung na německé Wikipedii.
- HUDLICKÝ, Miloš. Reductions in Organic Chemistry. Washington, D.C.: American Chemical Society, 1996. Dostupné online. ISBN 0-8412-3344-6. S. 429.
- Catalytic Hydrogenation of Maleic Acid at Moderate Pressures A Laboratory Demonstration Kwesi Amoa 1948 Journal of Chemical Education • Vol. 84 No. 12 December 2007
Literatura
- Jang ES, Jung MY, Min DB. Hydrogenation for Low Trans and High Conjugated Fatty Acids. Comprehensive Reviews in Food Science and Food Safety. 2005, roč. 1. Dostupné v archivu pořízeném dne 17-12-2008. Archivováno 17. 12. 2008 na Wayback Machine
- Starší práce o transferové hydrogenaci: Davies, R. R.; Hodgson, H. H. J. Chem. Soc. 1943, 281. Leggether, B. E.; Brown, R. K. Can. J. Chem. 1960, 38, 2363. Kuhn, L. P. J. Am. Chem. Soc. 1951, 73, 1510.
- Fred A. Kummerow. Cholesterol Won't Kill You, But Trans Fat Could. [s.l.]: Trafford, 2008. ISBN 142513808X.
Externí odkazy
 Obrázky, zvuky či videa k tématu Hydrogenace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydrogenace na Wikimedia Commons - Organic Syntheses, Coll. Vol. 7, p.226 (1990).
- Organic Syntheses, Coll. Vol. 8, p.609 (1993).
- Organic Syntheses, Coll. Vol. 5, p.552 (1973).
- Organic Syntheses, Coll. Vol. 3, p.720 (1955).
- Organic Syntheses, Coll. Vol. 6, p.371 (1988).