Reformatského reakce
Reformatského reakce je organická reakce, při níž kondenzuje aldehyd nebo keton s α-haloesterem za přítomnosti zinku a vytvoří se β-hydroxyester:[1][2]

Organozinečnatý reaktant, také nazývaný „Reformatského enolát“, se připravuje reakcí alfa-haloesteru s práškovým zinkem. Reformatského enoláty jsou méně reaktivní než lithné enoláty nebo Grignardova činidla a nedochází tak k nukleofilním adicím na esterové skupiny.
Bylo vydáno několik prací zabývajících se touto reakcí.[3][4]
Struktura reaktantu
Byly určeny krystalové struktury tetrahydrofuranových komplexů Reformatského činidel terc-butyl bromzinkacetátu[5] a ethylbromzinkacetátu.[6] Obě tyto látky vytvářejí v pevném skupenství cyklické osmičlenné dimery, mají však odlišnou stereochemii: osmičlenné kruhy ethylového derivátu zaujímají vaničkovou konformaci, mají bromové skupiny v poloze cis a cis-tetrahydrofuranové ligandy, zatímco u terc-butylové sloučeniny má kruh židličkovou konformaci a bromové skupiny i tetrahydrofuranové ligandy se nacházejí v poloze trans.
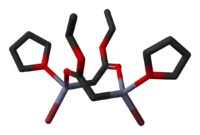 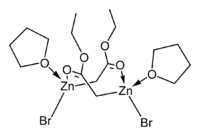 | 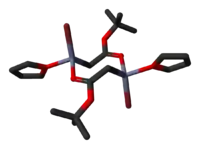 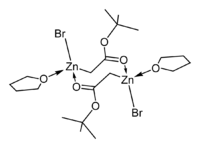 |
| dimerethylbromzinkacetátu | dimer terc-butyl bromzinkacetátu |
Mechanismus
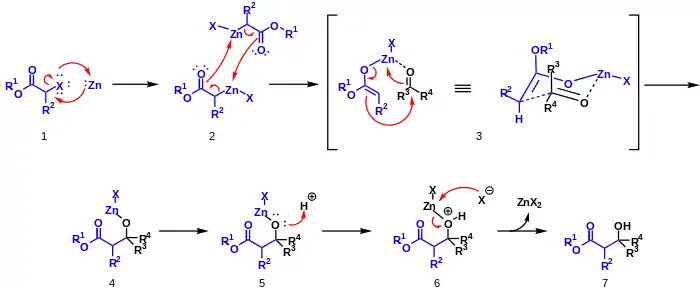
Zinek se oxidační adicí naváže na vazbu uhlík-halogen v molekule α-haloesteru 1. Vzniklá sloučenina se dimerizuje a přesmykuje na dva zinečnaté enoláty 2. Kyslík v molekule aldehydu nebo ketonu se koordinuje se zinkem za vzniku šestičlenného přechodného stavu s židličkovou konformací 3. Následně proběhne přesmyk, v němž se zinek přesune na karbonylový kyslík a vznikne vazba uhlík–uhlík 4. Přidání kyseliny vede k odštěpení zinku 5,6 a tvorbě zinečnaté soli a β-hydroxy-esteru 7.[7]
Obměny
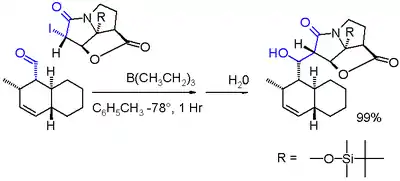
Při jedné z variant Reformatského reakce reaguje jodolaktam s aldehydem a triethylboranem v toluenu při -78 °C.[8]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Reformatsky reaction na anglické Wikipedii.
- S. Reformatsky. Neue Synthese zweiatomiger einbasischer Säuren aus den Ketonen. Berichte der Deutschen Chemischen Gesellschaft. 1887, s. 1210–1211. Dostupné online. DOI 10.1002/cber.188702001268.
- S. Reformatsky. Neue Synthese zweiatomiger einbasischer Säuren aus den Ketonen. Russian Journal of Physical Chemistry. 1890, s. 44.
- R. L. Shriner. The Reformatsky Reaction. Organic Reactions. 1942, s. 1–37. ISBN 9780471264187. DOI 10.1002/0471264180.or001.01.
- M. W. Rathke. The Reformatsky Reaction. Organic Reactions. 1975, s. 423–460. ISBN 0471264180. DOI 10.1002/0471264180.or022.04.
- J. Dekker; P. H. M. Budzelaar; J. Boersma; G. J. M. van der Kerk; A. J. Spek. The Nature of the Reformatsky Reagent. Crystal Structure of (BrZnCH2COO-t-Bu · THF)2. Organometallics. 1984, s. 1403–1407. DOI 10.1021/om00087a015.
- S. Miki; K. Nakamoto; J. Kawakami; S. Handa; S. Nuwa. The First Isolation of Crystalline Ethyl Bromozincacetate, Typical Reformatsky Reagent: Crystal Structure and Convenient Preparation. Synthesis. 2008, s. 409–412. DOI 10.1055/s-2008-1032023.
- Kurti, L.; Czako, B. Strategic Applications of Named Reactions in Organic Synthesis; Elsevier: Burlington, 2005.
- T. H. Lambert; S. J. Danishefsky. Total Synthesis of UCS1025A. Journal of the American Chemical Society. 2006, s. 426–427. DOI 10.1021/ja0574567. PMID 16402826.