Radikálová fluorace
Radicalkálová fluorace je druh fluorační reakce, který je doplňkem nukleofilní a elektrofilní fluorace.[1] Spočívá v reakci radikálu se zdrojem atomárního fluoru a vzniká při ní fluorovaná sloučenina.
![]()
Původně byly k dispozici pouze tři zdroje atomárního fluoru: fluor (F2), fluornany a fluorid xenonatý (XeF2). Vysoká reaktivita a obtížné skladování F2 a fluornanů omezovalo rozvoj radikálové fluorace.[2] Byla však objevena elektrofilní N—F fluorační činidla, která lze rovněž použít jako zdroje fluoru;[3] tento objev vedl k obnovení využívání radikálové fluorace.[2]
Je známo několik způsobů radikálové tvorby vazeb C—F.[1] tento objev vedl k obnovení využívání radikálové fluorace.[2] Radikálové meziprodukty se vytvářejí z derivátů karboxylových kyselin a kyseliny borité, a to radikálovou adicí na alkeny, nebo aktivací vazeb C—H a C—C. Vyvíjejí se nové zdroje atomárního fluoru, jako jsou například komplexy fluoridů kovů.
Zdroje fluoru
Plynný fluor
Plynný fluor lze použít jako elektrofilní i atomární zdroj fluoru.[4] Nízká energie vazeb F—F (150 kJ/mol[5]) umožňuje homolytické štěpení. Reakce F2 s organickými sloučeninami jsou ovšem značně exotermické a mohou způsobovat neselektivní fluorace a štěpení vazeb C—C, dokonce může dojít k výbuchu.[6] Popsáno bylo pouze několik selektivních metod radikálové fluorace.[7][8] Použití fluoru k radikálové fluoraci je převážně omezeno na perfluorační reakce.[5]
O—F reaktanty
Vazby O—F u fluornanů jsou poměrně slabé, například u CF3OF je vazebná energie přibližně 182 kJ/mol.[9] Schopnost této látky fluorovat alkylové radikály byla ukázána na reakci ethylových radikálů vytvořených z ethenu a tritia za přítomnosti CF3OF.[10] Vysoká reaktivita fluornanů omezuje jejich využití při selektivních radikálových fluoracích, mohou však být použity jako radikálové iniciátory při polymerizaci.[11]
Fluorid xenonatý
Nejčastější využití fluoridu xenonatého k radikálové fluoraci je při dekarboxylačních fluoracích.[12] Při těchto Hunsdieckerových reakcích slouží fluorid xenonatý jako zdroj radikálových meziproduktů a fluoru.[13]
![]()
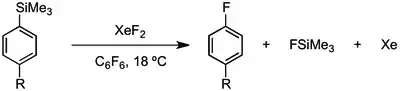
XeF2 může být také použit na tvorbu arylových radikálů z arylsilanů a může sloužit jako zdroj atomárního fluoru při přípravě arylfluoridů.[14]
N—F reaktanty
Jako elektrofilní zdroje fluoru se běžně používají selektfluor a N-fluorbenzennsulfonimid (NFSI), protože mají schopnost dodávat fluor na alkylové radikály.[3][1]
Druhy radikálové fluorace
Dekarboxylační fluorace
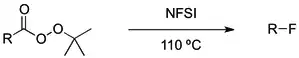
Ternolýzou t-butylperesterů lze za přítomnosti NFSI a selectfluoru získat alkylové radikály.[3] Radikálové meziprodukty se účinně fluorují působením dvou elektrofilních fluoračních činidel.
Jako prekurzory radikálů je možné použít karboxylové kyseliny. K usnadnění fluordekarboxylace lze použít kovové katalyzátory, například stříbro[17] a mangan;[18] také je možné využít fotoredoxní katalýzu.[19][20] Deriváty kyseliny fenoxyoctové mohou být fluordekarboxylovány vystavením ultrafialovému záření[21] nebo pomocí fotosenzitizátoru.[22]

Radikálová fluorace alkenů
Radikály vzniklé z alkenů mohou být také fluorovány. Lze využít hydridy[23] a radikály s dusíkovými,[24] uhlíkovými[25] a fosforovými centry;[26] tímto způsobem je možné připravit mnoho různých difluorovaných sloučenin.
Fluorace derivátů kyseliny borité
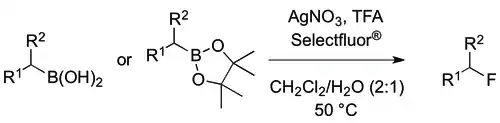
Alkylfluoridy lze připravit z radikálů odvozených od derivátů kyseliny borité za katalýzy stříbrem.[27]
C(sp3)—H fluorace
Jednou z hlavních výhod radikálové fluorace je to, že lze provést fluoraci vzdálených vazeb C—H. Katalyzátory zde bývají kovy, například mangan,[28] měď[29] a wolfram.[30]. C(sp3)—H fluorace lze provést i bez použití kovů, které se nahradí iniciátory radikálů (Et3B[31], peroxosiřičitany[32] a N-oxylové radikály[33]) nebo organickými fotokatalyzátory.[33]
Byly též vyvinuty metody selektivní fluorace benzylových vazeb C—H.[34]
Využití
Jedním z možných využití radikálové fluorace je příprava různých funkčních skupin, které jsou součástmi molekul léčiv.[38] K tomuto účelu lze použít například deriváty [1.1.1]-propelanu s reaktivními funkčními skupinami, jako jsou hydrochloridy 3-fluorbicyklo[1.1.1]pentan-1-aminu.[38]
Reference
V tomto článku byl použit překlad textu z článku Radical fluorination na anglické Wikipedii.
- Jean-François Paquin; Glenn M. Sammis; Joe C. T. Leung; Glenn M. Sammis. Recent Advances in Radical Fluorination. Synthesis. 2015-08-03, s. 2554–2569. DOI 10.1055/s-0034-1378824.
- Mukund P. Sibi; Yannick Landais. Csp3—F Bond Formation: A Free-Radical Approach. Angewandte Chemie International Edition. 2013, s. 3570–3572. DOI 10.1002/anie.201209583. PMID 23441011.
- Montserrat Rueda-Becerril; Claire Chatalova Sazepin; Joe C. T. Leung; Tulin Okbinoglu; Pierre Kennepohl; Jean-François Paquin; Glenn M. Sammis. Fluorine Transfer to Alkyl Radicals. Journal of the American Chemical Society. 2012-03-07, s. 4026–4029. ISSN 0002-7863. DOI 10.1021/ja211679v. PMID 22320293.
- Lucius A. Bigelow. The Action of Elementary Fluorine upon Organic Compounds. Chemical Reviews. 1947-02-01, s. 51–115. ISSN 0009-2665. DOI 10.1021/cr60125a004.
- John Hutchinson; John Hutchinson. Elemental Fluorine in Organic Chemistry. [s.l.]: Springer Berlin Heidelberg, 1997-01-01. Dostupné online. ISBN 978-3-540-63170-5. DOI 10.1007/3-540-69197-9_1. S. 1–43.
- J. H. Simons; L. P. Block. Fluorocarbons. The Reaction of Fluorine with Carbon. Journal of the American Chemical Society. 1939-10-01, s. 2962–2966. ISSN 0002-7863. DOI 10.1021/ja01265a111.
- Vytautas Grakauskas. Aqueous fluorination of carboxylic acid salts. The Journal of Organic Chemistry. 1969-08-01, s. 2446–2450. DOI 10.1021/jo01260a040.
- Wilhelm Bockemüller. Versuche zur Fluorierung organischer Verbindungen. III. Über die Einwirkung von Fluor auf organische Verbindungen. Justus Liebigs Annalen der Chemie. 1933-01-01, s. 20–59. DOI 10.1002/jlac.19335060103.
- J. Czarnowski; E. Castellano; H. J. Schumacher. The energy of the O?F bond in trifluoromethyl hypofluorite. Chemical Communications (London). 1968, s. 1255. DOI 10.1039/c19680001255.
- Nunyii Wang; F. S. Rowland. Trifluoromethyl hypofluorite: a fluorine-donating radical scavenger. The Journal of Physical Chemistry. 1985-11-01, s. 5154–5155. ISSN 0022-3654. DOI 10.1021/j100270a006.
- Francesco Venturini; Maurizio Sansotera; Walter Navarrini. Recent developments in the chemistry of organic perfluoro hypofluorites. Journal of Fluorine Chemistry. 2013-11-01, s. 2–20. ISSN 0022-3654. DOI 10.1016/j.jfluchem.2013.07.005.
- Marcus A. Tius. Xenon difluoride in synthesis. Tetrahedron. 1995-06-12, s. 6605–6634. ISSN 0022-3654. DOI 10.1016/0040-4020(95)00362-C.
- Timothy B. Patrick; Diana L. Darling. Fluorination of activated aromatic systems with cesium fluoroxysulfate. The Journal of Organic Chemistry. 1986-08-01, s. 3242–3244. ISSN 0022-3263. DOI 10.1021/jo00366a044.
- Aileen P. Lothian; Christopher A. Ramsden. Rapid Fluorodesilylation of Aryltrimethylsilanes Using Xenon Difuoride: An Efficient New Route to Aromatic Fluorides. Synlett. 1993-01-01, s. 753–755. DOI 10.1055/s-1993-22596.
- Shigeyuki Yamada; Shlomo Rozen. Constructing the CF3 group; unique trifluorodecarboxylation induced by BrF3. Tetrahedron. 2005-01-31, s. 1083–1086. DOI 10.1016/j.tet.2004.11.063.
- Revital Sasson; Andrei Gavryushin; Paul Knochel. Convenient Electrophilic Fluorination of Functionalized Aryl and Heteroaryl Magnesium Reagents. Angewandte Chemie International Edition. 2010, s. 2215–2218. DOI 10.1002/anie.200905052. PMID 20162637.
- Feng Yin; Zhentao Wang; Zhaodong Li; Chaozhong Li. Silver-Catalyzed Decarboxylative Fluorination of Aliphatic Carboxylic Acids in Aqueous Solution. Journal of the American Chemical Society. 2012-06-27, s. 10401–10404. ISSN 0002-7863. DOI 10.1021/ja3048255. PMID 22694301.
- Xiongyi Huang; Wei Liu; Jacob M. Hooker; John T. Groves. Targeted Fluorination with the Fluoride Ion by Manganese-Catalyzed Decarboxylation. Angewandte Chemie International Edition. 2015-04-20, s. 5241–5245. ISSN 1521-3773. DOI 10.1002/anie.201500399. PMID 25736895.
- Direct C–F Bond Formation Using Photoredox Catalysis. Journal of the American Chemical Society. 2014-01-30, s. 2637–2641. DOI 10.1021/ja412083f. PMID 24437369.
- Sandrine Ventre; Filip R. Petronijevic; David W. C. MacMillan. Decarboxylative Fluorination of Aliphatic Carboxylic Acids via Photoredox Catalysis. Journal of the American Chemical Society. 2015-04-27, s. 5654–5657. DOI 10.1021/jacs.5b02244. PMID 25881929.
- Joe C. T. Leung; Claire Chatalova-Sazepin; Julian G. West; Montserrat Rueda-Becerril; Jean-François Paquin; Glenn M. Sammis. Photo-fluorodecarboxylation of 2-Aryloxy and 2-Aryl Carboxylic Acids. Angewandte Chemie International Edition. 2012-10-22, s. 10804–10807. DOI 10.1002/anie.201206352. PMID 23023887.
- Joe C. T. Leung; Glenn M. Sammis. Radical Decarboxylative Fluorination of Aryloxyacetic Acids Using N-Fluorobenzenesulfonimide and a Photosensitizer. European Journal of Organic Chemistry. 2015-04-01, s. 2197–2204. ISSN 1099-0690. DOI 10.1002/ejoc.201500038.
- Timothy J. Barker; Dale L. Boger. Fe(III)/NaBH 4 -Mediated Free Radical Hydrofluorination of Unactivated Alkenes. Journal of the American Chemical Society. 2012-08-07, s. 13588–13591. DOI 10.1021/ja3063716. PMID 22860624.
- Zhaodong Li; Chengwei Zhang; Lin Zhu; Chao Liu; Chaozhong Li. Transition-metal-free, room-temperature radical azidofluorination of unactivated alkenes in aqueous solution. Org. Chem. Front.. 2014-02-18, s. 100–104. DOI 10.1039/c3qo00037k.
- Stephanie Kindt; Markus R. Heinrich. Intermolecular Radical Carbofluorination of Non-activated Alkenes. Chemistry: A European Journal. 2014-11-17, s. 15344–15348. ISSN 1521-3765. DOI 10.1002/chem.201405229. PMID 25303212.
- Chengwei Zhang; Zhaodong Li; Lin Zhu; Limei Yu; Zhentao Wang; Chaozhong Li. Silver-Catalyzed Radical Phosphonofluorination of Unactivated Alkenes. Journal of the American Chemical Society. 2013-09-13, s. 14082–14085. DOI 10.1021/ja408031s. PMID 24025164.
- Zhaodong Li; Zhentao Wang; Lin Zhu; Xinqiang Tan; Chaozhong Li. Silver-Catalyzed Radical Fluorination of Alkylboronates in Aqueous Solution. Journal of the American Chemical Society. 2014-11-06, s. 16349–16443. DOI 10.1021/ja509548z. PMID 25350556.
- Wei Liu; Xiongyi Huang; Mu-Jeng Cheng; Robert J. Nielsen; William A. Goddard; John T. Groves. Oxidative Aliphatic C-H Fluorination with Fluoride Ion Catalyzed by a Manganese Porphyrin. Science. 2012-09-14, s. 1322–1325. Dostupné online. ISSN 0036-8075. DOI 10.1126/science.1222327. PMID 22984066. Bibcode 2012Sci...337.1322L.
- Steven Bloom; Cody Ross Pitts; David Curtin Miller; Nathan Haselton; Maxwell Gargiulo Holl; Ellen Urheim; Thomas Lectka. A Polycomponent Metal-Catalyzed Aliphatic, Allylic, and Benzylic Fluorination. Angewandte Chemie International Edition. 2012-10-15, s. 10580–10583. ISSN 1521-3773. DOI 10.1002/anie.201203642. PMID 22976771.
- Shira D. Halperin; Hope Fan; Stanley Chang; Rainer E. Martin; Robert Britton. A Convenient Photocatalytic Fluorination of Unactivated C—H Bonds. Angewandte Chemie International Edition. 2014, s. 4690–4693. DOI 10.1002/anie.201400420. PMID 24668727.
- Cody Ross Pitts; Bill Ling; Ryan Woltornist; Ran Liu; Thomas Lectka. Triethylborane-Initiated Radical Chain Fluorination: A Synthetic Method Derived from Mechanistic Insight. The Journal of Organic Chemistry. 2014-08-27, s. 8895–8899. DOI 10.1021/jo501520e. PMID 25137438.
- Xiaofei Zhang; Shuo Guo; Pingping Tang. Transition-metal free oxidative aliphatic C–H fluorination. Org. Chem. Front.. 2015-06-05, s. 806–810. DOI 10.1039/c5qo00095e.
- Yuuki Amaoka; Masanori Nagatomo; Masayuki Inoue. Metal-Free Fluorination of C(sp 3)–H Bonds Using a Catalytic N -Oxyl Radical. Organic Letters. 2013-04-19, s. 2160–2163. DOI 10.1021/ol4006757. PMID 23600550.
- Ana Koperniku; Hongqiang Liu; Paul B. Hurley. Mono- and Difluorination of Benzylic Carbon Atoms. European Journal of Organic Chemistry. 2016-01-15, s. 871–886. ISSN 1099-0690. DOI 10.1002/ejoc.201501329.
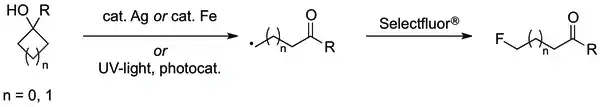
- Naoki Ishida; Shintaro Okumura; Yuuta Nakanishi; Masahiro Murakami. Ring-opening Fluorination of Cyclobutanols and Cyclopropanols Catalyzed by Silver. Chemistry Letters. 2015-01-01, s. 821–823. Dostupné online. DOI 10.1246/cl.150138.
- Shichao Ren; Chao Feng; Teck-Peng Loh. Iron- or silver-catalyzed oxidative fluorination of cyclopropanols for the synthesis of β-fluoroketones. Organic and Biomolecular Chemistry. 2015-04-29, s. 5105–5109. DOI 10.1039/c5ob00632e. PMID 25866198.
- Steven Bloom; Desta Doro Bume; Cody Ross Pitts; Thomas Lectka. Site-Selective Approach to β-Fluorination: Photocatalyzed Ring Opening of Cyclopropanols. Chemistry: A European Journal. 2015-05-26, s. 8060–8063. ISSN 1521-3765. DOI 10.1002/chem.201501081. PMID 25877004.
- Y. L. Goha; V. A. Adsool. Radical fluorination powered expedient synthesis of 3-fluorobicyclo[1.1.1]pentan-1-amine. Organic and Biomolecular Chemistry. 2015, s. 11597–11601. DOI 10.1039/C5OB02066B. PMID 26553141.