1,1,1,2-tetrafluorethan
1,1,1,2-tetrafluorethan, také nazývaný HFC-134a nebo R-134a, je organická sloučenina, tetrafluorderivát ethanu. Používá se jako chladivo, jeho termodynamické vlastnosti jsou podobné R-12 (dichlordifluormethanu), ovšem na rozdíl od něj není škodlivý pro ozonovou vrstvu a má poněkud menší potenciál globálního oteplování (1430 oproti 10 900 u R12).[2] Používá se jako chladivo, ovšem je snaha nahradit jej látkami s nižším potenciálem globálního oteplování jako je 2,3,3,3-tetrafluorpropen.
| 1,1,1,2-tetrafluorethan | |
|---|---|
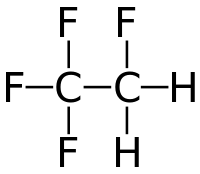
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | 1,1,1,2-tetrafluorethan |
| Ostatní názvy | HFC-134a, R-134a |
| Anglický název | 1,1,1,2-Tetrafluoroethane |
| Sumární vzorec | C2H2F4 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 811-97-2 |
| SMILES | FCC(F)(F)F |
| InChI | 1S/C2H2F4/c3-1-2(4,5)6/h1H2 |
| Číslo RTECS | KI8842500 |
| Vlastnosti | |
| Molární hmotnost | 102,031 g/mol |
| Teplota tání | −103,3 °C (169,8 K) |
| Teplota varu | −26,3 °C (246,8 K) |
| Hustota | 4,25 kg/m3 (plyn) |
| Rozpustnost ve vodě | nerozpustný |
| Bezpečnost | |
| [1] Varování[1] | |
| S-věty | S2 S23 S24/25 S51 |
| Teplota vzplanutí | 250 °C (523 K) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Tetrafluorethan se obvykle vyrábí reakcí trichlorethylenu s fluorovodíkem[3]:
- CHCl=CCl2 + 4 HF → CH2FCF3 + 3 HCl
Použití
1,1,1,2-tetrafluorethan je nehořlavá látka, která se používá hlavně jako „vysokoteplotní“ chladivo v domácnostech a v automobilových klimatizacích. Tato zařízení začala být používána v 90. letech 20. století jako náhrada za pro životní prostředí škodlivější látku R-12. Také se používá na foukání molitanu, jako čisticí rozpouštědlo, hnací plyn při doručování léčiv (například bronchodilatancií), na odstraňování korkových uzávěrů a ve vysušovačích vzduchu. Další využití nachází jako hnací plyn v airsoftových zbraních.
1,1,1,2-tetrafluorethan je rovněž považován za organické rozpouštědlo vhodné k extrakci aromat a vůní jako možná alternativa k ostatním organickým látkám a superkritickému CO2.[4][5]
Lze jej také použít jako rozpouštědlo v organické chemii (kapalný i superkritický).[6] Rovněž se nachází v některých částicových detektorech v LHC.[7][8] Může být, namísto fluoridu sírového, použit jako ochranný plyn při tavení hořčíku.[9]
Omezení kvůli vlivu na změnu klimatu
Používání 1,1,1,2-tetrafluorethanu je omezováno kvůli jeho vlivu na globální oteplování[10], je to 1300krát silnější skleníkový plyn než oxid uhličitý.[11]
Bezpečnost
Směsi vzduchu s 1,1,1,2-tetrafluorethanem jsou nehořlavé při normálním atmosférickém tlaku a teplotách do 100 °C. Směsi s vysokým podílem vzduchu ovšem mohou být při zvýšené tlaku či teploty zapáleny.[12] Dostane-li se tato látka do styku s plamenem nebo předmětem zahřátým nad 250 °C, může dojít k rozkladu par a vzniku toxických plynů jako jsou fluorovodík a karbonylfluorid.[13] Samotný 1,1,1,2-tetrafluorethan je relativně netoxický, nebezpečí však představuje při vdechnutí; jelikož je jeho plynná forma hustší než vzduch, usazuje se v plicích, což může způsobit dušení.[14][15] Toto je příčina většiny úmrtí při vdechnutí.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku 1,1,1,2-Tetrafluoroethane na anglické Wikipedii.
- 1,1,1,2-Tetrafluoroethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Table 2.14 (Errata). Lifetimes, radiative efficiencies and direct (except for CH4) GWPs relative to CO2. [online]. [cit. 2017-07-11]. Dostupné v archivu pořízeném dne 2017-07-06. (anglicky)
- http://www.solvay.us/en/binaries/PSS-Tetrafluoroethane-164368.pdf
- CORR, Stuart. Natural Flavors and Fragrances. [s.l.]: [s.n.], 2005. Dostupné online. ISBN 0-8412-3904-5. DOI 10.1021/bk-2005-0908.ch003. Kapitola 1,1,1,2-Tetrafluoroethane (R-134a): A Selective Solvent for the Generation of Flavor and Fragrance Ingredients, s. 41.
- ABBOTT, Andrew P.; ELTRINGHAM, Wayne; HOPE, Eric G.; NICOLA, Mazin. Solubility of unsaturated carboxylic acids in supercritical 1,1,1,2-tetrafluoroethane (HFC 134a) and a methodology for the separation of ternary mixtures. Green Chemistry. 2005, roč. 7, čís. 4, s. 210. DOI 10.1039/B412697A. (anglicky)
- ABBOTT, Andrew P.; ELTRINGHAM, Wayne; HOPE, Eric G.; NICOLA, Mazin. Hydrogenation in supercritical 1,1,1,2 tetrafluoroethane (HFC 134a). Green Chemistry. 2005, roč. 7, čís. 10, s. 721. DOI 10.1039/B507554H. (anglicky)
- Anushree Ghosh STUDY OF GLASS RESISTIVE PLATE CHAMBERS (RPC) AND CALCULATION OF EFFICIENCY Archivováno 7. 8. 2011 na Wayback Machine. INO Graduate Training Programme DHEP, TIFR, Mumbai.
- M. Capeans, I. Glushkov, R. Guida, F. Hahn, S. Haider (CERN, Switzerland) RPC operation at the LHC experiments in an optimized closed loop gas system. Medical Imaging Conference. 25–31 October 2009.
- Magnesium recycling in the United States in 1998. (PDF) . USGS. Retrieved on 2011-08-21.
- European Directive 2006/40/EC relating to emissions from air-conditioning systems in motor vehicles Archivováno 3. 8. 2012 na Wayback Machine. (PDF) . Retrieved on 2011-08-21.
- Compressed air dusters and environmental concerns. (PDF). Retrieved on 2015-05-26.
- Šablona:Cite report
- Honeywell International. MSDS # GTRN-0047 For Genetron 134aUV. [s.l.]: [s.n.], December 2005. (anglicky)
- Alexander D. J; Libretto S. E. An overview of the toxicology of HFA-134a (1,1,1,2-tetrafluoroethane). Hum. Exp. Toxicol.. 1995, roč. 14, čís. 9, s. 715–20. DOI 10.1177/096032719501400903. PMID 8579881. (anglicky)
- G. E. Millward; E. Tschuikow-Roux. Kinetic analysis of the shock wave decomposition of 1,1,1,2-tetrafluoroethane. The Journal of Physical Chemistry. 1972, roč. 76, čís. 3, s. 292–298. DOI 10.1021/j100647a002. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu 1,1,1,2-tetrafluorethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu 1,1,1,2-tetrafluorethan na Wikimedia Commons
