Karbonylfluorid
Karbonylfluorid je organická sloučenina se vzorcem COF2. Je podobný fosgenu, jen místo chlorových atomů má atomy fluoru, fosgenu se podobá i tím, že je vysoce toxický.
Molekula je planární se symetrií C2v.
| Karbonylfluorid | |
|---|---|
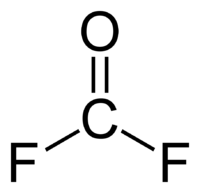
Strukturní vzorec | |
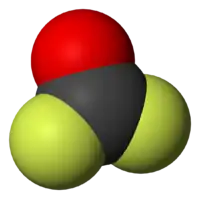
Model molekuly | |
| Obecné | |
| Systematický název | Karbonylfluorid |
| Ostatní názvy | Fluorofosgen Karbonyldifluorid Oxyfluorid uhličitý |
| Anglický název | Carbonyl fluoride Carbonyl difluoride Fluorophosgene Carbon difluoride oxide |
| Německý název | Carbonylfluorid |
| Sumární vzorec | COF2 |
| Vzhled | Bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 353-50-4 |
| UN kód | 2417 |
| SMILES | FC(F)=O |
| InChI | 1S/CF2O/c2-1(3)4 |
| Číslo RTECS | FG6125000 |
| Vlastnosti | |
| Molární hmotnost | 66,010 g/mol |
| Teplota tání | −111,26 °C |
| Teplota varu | −84,57 °C |
| Hustota | 0,002 698 g/cm3 (plyn) |
| Struktura | |
| Tvar molekuly | C2v |
| Dipólový moment | 0,95 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 |  0
4
2
|
| Teplota vzplanutí | Nehořlavý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Reakce
Karbonylfluorid je za přítomnosti vody nestabilní a obdobně jako fosgen hydrolyzuje:
COF2 + 2 H2O → 2 HF + H2CO3.
Bezpečnost
Karbonylfluorid je extrémně toxický a vdechování může skončit smrtí. Nejvyšší povolená koncentrace při krátkodobé expozici je 2 ppm.
Reference
V tomto článku byl použit překlad textu z článku Carbonyl fluoride na anglické Wikipedii.
- Carbonyl fluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Karbonylfluorid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Karbonylfluorid na Wikimedia Commons
Portály: Chemie
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



