Protodeborace
Protodeborace nebo protodeborylace je chemická reakce, při které dochází k protonolýze boronové kyseliny (nebo jiné organoboranové sloučeniny) a vazba uhlík–bor je nahrazena vazbou uhlík–vodík. Protodeborace je častou vedlejší reakcí, zejména u kovy katalyzovaných párovacích reakcí využívajících boronové kyseliny, jako je například Suzukiova reakce.[1] Náchylnost jednotlivých boronových kyselin k protodeboraci může být značně odlišná a závisí na mnoha faktorech, jako jsou reakční podmínky a organické substituenty boronové kyseliny.
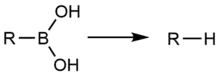
Záměrné protodeborace boronových kyselin a jejich derivátů jsou součástmi několika syntetických procesů, například stereospecifických navazování protonů na chirální centra,[2] a při přečišťování, například za účelem odstranění vedlejších produktů s nežádoucí regioizomerií.[3]
Mechanistickými studiemi byla nalezena řada různých mechanismů protodeborací ve vodném prostředí a zjistilo se, že pH, při kterém je reakce prováděna, je důležitým faktorem při jejich zkoumání.[4][5]

Historie
Jednu z prvních studií popisujících protodeboraci provedli A. D. Ainley a F. Challenger, jež byli prvními vědci zkoumajícími reakce boronových kyselin s běžnými činidly.[6] Popsali reakci kyseliny fenylboronové ve vodě za teploty 140–150 °C, při níž vznikal protodeborovaný produkt, benzen, po 40 hodinách.
Protodeborace nalezly syntetická využití společně s hydroboracemi, kdy se posloupnosti hydroboračních a protodeboračních reakcí použily na přeměnu alkynů a alkenů na příslušné nasycené sloučeniny.[7] Začátkem 20. století neměly protodeborace mnoho jiných využití, později však byly rozpoznány jako vedlejší reakce mnoha chemických procesů, do kterých byly zapojeny boronové kyseliny. Boronové kyseliny se stávaly významnými reaktanty při tvorbě vazeb uhlík–uhlík a uhlík–heteroatom pomocí kovy katalyzovaných párovacích rekcí. Tímto došlo k nárůstu využívání boronových kyselin a následně řadě případů potíží s protodeboracemi. Mnoho boronových kyselin je nyní komerčně dostupných a řada nových se objevuje.
Bylo vynaloženo mnoho úsilí k potlačení nechtěných protodeborací. Úpravy katalyzátorů vedly k vysoce účinným systémům.[8] Tím došlo k navýšení rychlostí produktivních reakcí a zmenšení vlivu těch vedlejších, jako jsou protodeborace. Párovací reakce se podařilo urychlit přidáním kovů, jako je stříbro[9][10][11][12] a měď.[13][14]
K omezení nežádoucích protodeborací byly též použity deriváty boronových kyselin.[15] MIDA boronátové estery a organotrifluorboráty byly použity při optimalizaci reakcí vytvářejících boronové kyseliny pomalu; tento postup se ukázal být účinným u párování několika nestabilních boronových kyselin, jako je kyselina 2-pyridinboronová.[16][17] Tím byla zajištěna nízká koncentrace boronové kyseliny v průběhu reakce, což vedlo k omezení vedlejších reakcí.
Mechanismus
U jednoduchých nezásaditých boronových kyselin
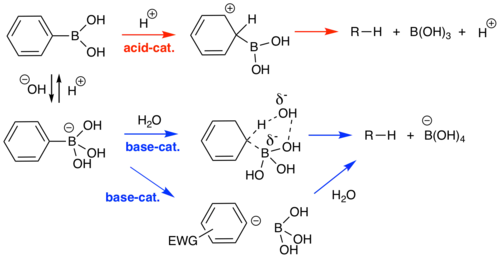
Mechanismus protodeborace poprvé zkoumal H. G. Kuivila v 60. letech 20. století, dlouho před objevem Suzukiovy reakce a popularizace boronových kyselin. Zaměřil se na protodeboraci několika substituovaných aromatických boronových kyselin ve vodných roztocích a popsal dva různé mechanismy; kysele katalyzovaný a zásaditě katalyzovaný.[18][19] Kysele katalyzovaný proces spočívá v reakci boronové kyseliny a katalyzující kyseliny, což může být například kyselina sírová. Zásaditě katalyzovaná obdoba začíná vznikem boronátu reakcí mezi boronovou kyselinou a hydroxidem, po čemž následuje reakce, obvykle určující rychlost celého procesu, boronátu s vodou, sloužící jako zdroj protonů. Substráty, u nichž se objevují pouze tyto dva mechanismy (obvykle jednoduché aromatické a alkylboronové kyseliny) jsou při neutrálním pH, kdy jsou oba procesy potlačeny, většinou stabilní. Aromatické boronové kyseliny obsahující substituenty odtahující elektrony vykazují také disociativní mechanismus zahrnující tvorbu arylaniontového meziproduktu. Tyto substráty jsou nejstabilnější v kyselém prostředí.[5]
U zásaditých heteroaromatických boronových kyselin
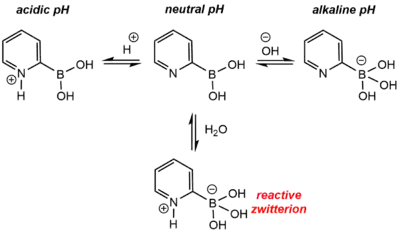
Zásadité heteroaromatické boronové kyseliny (obsahující zásaditý atom dusíku, například kyselina 2-pyridinboronová) mohou být protodeborovány i jinými mechanismy.[4] Jejich reakce jsou podobné jako u jednoduchých aminokyselin, kdy se za neutrálního pH tvoří zwitteriontové formy. U kyseliny 2-pyridinboronové zwitteriontová podoba způsobuje rychlou protodeboraci při neutrálním pH, a to přes jednomolekulární fragmentaci vazby C-B. Adice kyseliny (H+) nebo hydroxidu (OH−) protodeboraci oslabuje posunem mimo reaktivní zwitteriontovou formu.
Ne všechny zásadité heteroaromatické boronové kyseliny reagují skrz zwitteriontové meziprodukty.
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Protodeboronation na anglické Wikipedii.
- Boronic Acids: Preparation and Applications in Organic Synthesis, Medicine and Materials, 2nd ed.; Hall, D., Ed; Wiley VCH: Weinheim, Germany, 2011; Vols. 1 and 2, pp 1-133.
- Roesner, S.; Blair, D. J.; Aggarwal, V. K. "Enantioselective installation of adjacent tertiary benzylic stereocentres using lithiation–borylation–protodeboronation methodology. Application to the synthesis of bifluranol and fluorohexestrol". Chem. Sci. 2015, 6, 3718. DOI:10.1039/C4SC03901G
- Klingensmith, L. M.; Bio, M. M.; Moniz, G. A., "Selective protodeboronation: synthesis of 4-methyl-2-thiopheneboronic anhydride and demonstration of its utility in Suzuki-Miyaura reactions". Tetrahedron Lett. 2007, 48, 8242. DOI:10.1016/j.tetlet.2007.09.060
- Cox, P. A.; Leach, A. G.; Campbell, A. D.; Lloyd-Jones, G. C. "Protodeboronation of Heteroaromatic, Vinyl, and Cyclopropyl Boronic Acids: pH–Rate Profiles, Autocatalysis, and Disproportionation" J. Am. Chem. Soc. 2016, 138, 9145. DOI:10.1021/jacs.6b03283
- Cox, P. A.; Reid, M.; Leach A. G.; Campbell, A. D.; King, E. J.; Lloyd-Jones, G. C. "Base-Catalyzed Aryl-B(OH)2 Protodeboronation Revisited: From Concerted Proton Transfer to Liberation of a Transient Aryl Anion". J. Am. Chem. Soc. 2017, 139, 13156. DOI:10.1021/jacs.7b07444
- Ainley, A. D.; Challenger, F. "Studies of the boron-carbon linkage" J. Chem. Soc. 1930, 2171.
- Brown, H. C.; Zweifel, G. "Hydroboration. XI. The Hydroboration of Acetylenes—A Convenient Conversion of Internal Acetylenes into cis-Olefins and of Terminal Acetylenes into Aldehydes" J. Am. Chem. Soc. 1961, 83 (18), 3834. DOI:10.1021/ja01479a024
- Billingsley, K. L.; Anderson, K. W.; Buchwald, S. L. "A Highly Active Catalyst for Suzuki–Miyaura Cross-Coupling Reactions of Heteroaryl Compounds". Angew. Chemie Int. Ed. 2006, 45, 3484. DOI:10.1002/anie.200600493
- Chen, J.; Cammers-Goodwin, A. "2-(Fluorophenyl)pyridines by the Suzuki-Miyaura method: Ag2O accelerates coupling over undesired ipso substitution (SNAr) of fluorine" Tetrahedron Lett. 2003, 44, 1503.DOI:10.1016/S0040-4039(02)02793-4
- Nishihara, Y.; Onodera, H.; Osakada, K. "Synthesis and structural characterization of the first unsymmetrical from transmetallation between 2,4,6-trifluorophenylboronic acid and trans-Pd(C6F5)I(PEt3)2" Chem. Commun. 2004, 192. DOI:10.1039/b308741g
- Korenaga, T.; Kosaki, T.; Fukumura, R.; Ema, T.; Sakai, T. "Suzuki-Miyaura coupling reaction using pentafluorophenylboronic acid". Org. Lett. 2005, 7, 4915.DOI:10.1021/ol051866i
- Imao, D.; Glasspoole, B. W.; Laberge, V. S.; Crudden, C. M. "Cross Coupling Reactions of Chiral Secondary Organoboronic Esters With Retention of Configuration". J. Am. Chem. Soc. 2009, 131 (14), 5024.DOI:10.1021/ja8094075
- Leconte, N.; Keromnes-Wuillaume, A.; Suzenet, F.; Guillaumet, G. "Efficient Palladium-Catalyzed Synthesis of Unsymmetrical (Het)aryltetrazines". Synlett 2007, 204.DOI:10.1055/s-2007-967991
- Deng, J. Z.; Paone, D. V.; Ginnetti, A. T.; Kurihara, H.; Dreher, S. D.; Weissman, S. A.; Stauffer, S. R.; Burgey, C. S. "Copper-facilitated Suzuki reactions: application to 2-heterocyclic boronates". Org. Lett. 2009, 11, 345.DOI:10.1021/ol802556f
- Lennox, A. J. J.; Lloyd-Jones, G. C. "The Slow-Release Strategy in Suzuki–Miyaura Coupling". Isr. J. Chem. 2010, 50, 664.DOI:10.1002/ijch.201000074
- Knapp, D. M.; Gillis, E. P.; Burke, M. D. "A general solution for unstable boronic acids: slow-release cross-coupling from air-stable MIDA boronates.". J. Am. Chem. Soc. 2009, 131, 6961.DOI:10.1021/ja901416p
- Molander, G. A.; Ellis, N. "Organotrifluoroborates: Protected Boronic Acids That Expand the Versatility of the Suzuki Coupling Reaction". Acc. Chem. Res. 2007, 40, 275.DOI:10.1021/ar050199q
- Kuivila, H. G.; Reuwer, J. F.; Mangravite, J. A. "Electrophilic Displacement Reactions. X. General Acid Catalysis in the Protodeboronation of Areneboronic Acids". Canadian Journal of Chemistry 1963, 41, 3081. DOI:10.1021/ja01470a028
- Kuivila, H. G.; Nahabedian, K. V. "Electrophilic displacement reactions. XV. Kinetics and Mechanism of the Base-catalyzed Protodeboronation of Areneboronic Acids". J. Am. Chem. Soc. 1961, 83, 2159. DOI:10.1139/v63-451