Pinakolový přesmyk
Pinakolový přesmyk je organická reakce přeměňující 1,2-diol na karbonylovou sloučeninu. Jedná se o druh [1,2]-přesmyku probíhající v kyselém prostředí.[1]
Tuto reakci poprvé popsal Wilhelm Rudolph Fittig v roce 1860, kdy nechal reagovat dva arylhalogenidy v diethyletheru za přítomnosti sodíku.[2]
Mechanismus
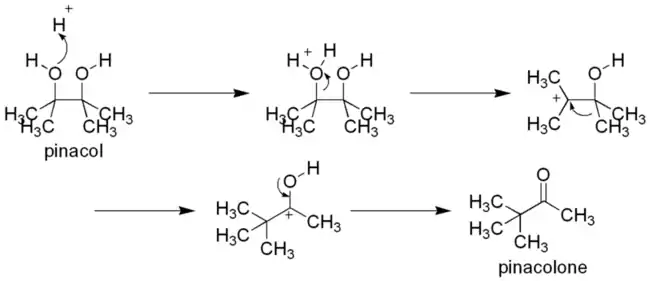
Pinakolový přesmyk začíná protonací jedné z hydroxylových skupin za vzniku karbokationtu. Pokud nejsou oba hydroxyly navázány na stejné uhlovodíkové skupiny (a pinakol je asymetrický), tak jedna z nich vytváří stabilnější karbokation. Následně se alkylová skupina ze sousedního uhlíku přesune na karbokationtové centrum.
Přesmyk je řízen relativní stabilitou oxoniových iontů. I když je už původní karbokation terciární, tak kyslík stabilizuje kladný náboj lépe, protože se tím vytvoří oktetová konfigurace na všech centrech. Volné elektronové páry hydroxylových skupin také působí na odsun alkylových skupin. Snadnost přesunu alkylů zde klesá v řadě vodík > fenylový karboanion > terciární karboanion (pokud se vytvoří) > sekundární karboanion (pokud se vytvoří) > methylový karboanion.
Ve výsledku se tak přesune skupina, která lépe stabilizuje karbokation.
Asymetrické pinakolové přesmyky
Pokud molekula pinakolu není symetrická, pak existují dvě možnosti, která hydroxylová skupina se oddělí a u kterého alkylu dojde k přesmyku. Selektivita je určována strabilitou karbokationtů.
Stereochemie
U cyklických sloučenin se vyskytuje více prvků, které jsou předměty zájmu. Při těchto reakcích má velký vliv stereochemie diolu. Přednostně se přesouvají alkylové skupiny v polohách trans vůči odstupujícímu hydroxylu. Dochází přitom k rozšiřování kruhu, kdy se na karbokation přesouvá uhlíkový atom, jenž je součástí cyklu. V důsledku toho je reakce soustředěná. Existuje souvislost mezi místem, odkud a kam se skupina přesouvá.
Pokud přesouvající se alkyl obsahuje chirální centrum, tak je konfigurace na tomto místě zachována i po skončení přesunu.
Historie
I když pinakolový přesmyk popsal jako první Wilhelm Rudolph Fittig, tak produkty reakce dokázal určit až Alexandr Butlerov.[3]
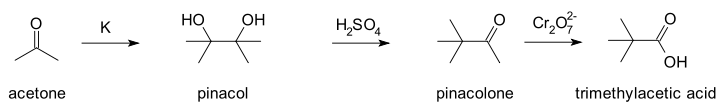
V roce 1859 popsal Wilhelm Rudolph Fittig reakci acetonu s kovovým draslíkem.[4]
Fittig použil pro aceton nesprávný vzorec (C3H3O)n a rovněž předpokládal, že jde o alkohol, což se pokusil dokázat příápravou příslušného alkoxidu. Produkt, který místo toho získal, nazval paraceton a považoval jej za dimer acetonu. V roce 1860 provedl reakci paracetonu s kyselinou sírovou (tedy skutečný pinakolový přesmyk).
Fittig nebyl schopen určit molekulovou strukturu tohoto produktu, o němž se domníval, že jde o další izomer nebo polymer. Charles Friedel předpokládal, že produktem je epoxid tetramethylethylenoxid,[5] vznikající podobně jako při reakci ethylenglykolu. V roce 1873 Butlerov určil správnou strukturu poté co nezávisle připravil kyselinu trimethyloctovou (pivalovou), kterou dříve získal Friedel oxidací pomocí dichromanu.[6]
Odkazy
Související články
- Polopinakolový přesmyk
- Tiffeneauův–Demjanovův přesmyk
- Benzilový přesmyk
Externí odkazy
 Obrázky, zvuky či videa k tématu Pinakolový přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pinakolový přesmyk na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Pinacol rearrangement na anglické Wikipedii.
- Jonathan Clayden; Nick Greeves; Stuart Warren. Organic chemistry. New York: Oxford University Press, 2012. ISBN 978-0-19-927029-3. S. 945.
- Wilhelm Rudolph Fittig. Über einige Derivate des Acetons. Annalen der Chemie und Pharmacie. 1860, s. 54–63. Dostupné online. DOI 10.1002/jlac.18601140107.
- Jerome A. Berson. What Is a Discovery? Carbon Skeletal Rearrangements as Counter-Examples to the Rule of Minimal Structural Change. Angewandte Chemie International Edition. 2002, s. 4655–4660. DOI 10.1002/anie.200290007. PMID 12481317.
- Wilhelm Rudolph Fittig. Ueber einige Metamorphosen des Acetons der Essigsäure. Annalen der Chemie und Pharmacie. 1859, s. 23–45. DOI 10.1002/jlac.18591100104.
- Charles Friedel. Recherches sur les acétones et sur les aldéhydes. Annales de chimie et de physique. 1869, s. 310. Dostupné online.
- Aleksandr Butlerov. Ueber Trimethylessigsäure. Justus Liebigs Annalen der Chemie und Pharmacie. 1873, s. 151–162. Dostupné online. DOI 10.1002/jlac.18731700114.