Oxid chloričitý
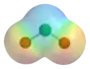
Oxid chloričitý je chemická sloučenina se sumárním vzorcem ClO2. Tento oranžový plyn krystalizuje při teplotě −59 °C do podoby oranžových krystalů. Jako jeden z oxidů chloru je účinným a užitečným oxidačním činidlem používaným při úpravě vody a při bělení. Oxid chloričitý je jediný známý oxid halogenu, kde je halogen v sudém oxidačním čísle. Molekula ClO2 obsahuje jeden nepárový elektron, jedná se tedy o volný radikál s paramagnetickými vlastnostmi.
| Oxid chloričitý | |
|---|---|
 | |
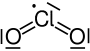 | |
 | |
| Obecné | |
| Systematický název | Oxid chloričitý |
| Anglický název | Chlorine dioxide |
| Německý název | Chlordioxid |
| Sumární vzorec | ClO2 |
| Vzhled | Oranžový plyn |
| Identifikace | |
| Registrační číslo CAS | 10049-04-4 |
| EC-no (EINECS/ELINCS/NLP) | 233-162-8 |
| Indexové číslo | 017-026-00-3 |
| PubChem | 24870 |
| Číslo RTECS | FO3000000 |
| Vlastnosti | |
| Molární hmotnost | 67,452 g/mol |
| Teplota tání | −59,5 °C |
| Teplota varu | 11 °C |
| Hustota | 1,64 g/cm3 (0 °C, kapalina) 0,003 04 g/cm3 (11 °C, plyn) |
| Rozpustnost ve vodě | 6,16 g/100 ml (4 °C) 2 000 cm³/100 ml (4 °C) |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v diethyletheru |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v tetrachlormethanu a ethanu |
| Tlak páry | 1,01 kPa (-64,5 °C) 10,1 kPa (-32,5 °C) 25,3 kPa (-17,2 °C) 50,6 kPa (--4,2 °C) |
| Struktura | |
| Dipólový moment | 5,95 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 102,6 kJ/mol |
| Entalpie varu ΔHv | 390 J/g |
| Standardní molární entropie S° | 256,9 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 120,6 kJ/mol |
| Izobarické měrné teplo cp | 0,623 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H270 H330 H314 H400 EUH006 |
| R-věty | R6, R8, R26, R34, R50 |
| S-věty | S1/2, S23, S26, S28, S36/37/39, S38, S45, S61 |
| NFPA 704 |  0
3
4
OX
|
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Plynný oxid chloričitý se zvláště za nízkých teplot dobře rozpouští ve vodě (přibližně 10krát více než chlor), přičemž prakticky nedochází k jeho hydrolýze. Při teplotě 25 °C a normálním tlaku je po dosažení rovnováhy jeho koncentrace ve vodě přibližně 23krát větší než v plynné fázi nad roztokem. Ve vodných roztocích oxid chloričitý existuje jako rozpuštěný plyn, je však velmi těkavý a může být snadno odstraněn provzdušňováním nebo intenzivním třepáním. Vodné roztoky podléhají fotolytickému rozkladu. Rozklad urychlují ionty přechodných kovů. Pokud jsou roztoky ClO2 skladovány v temnu a chladu, mohou si zachovat svou koncentraci po dobu několika dnů až měsíců. V přítomnosti chloridových iontů však dochází k rozkladu oxidu chloričitého i v temnu.[2]
Výroba
Při vyšších koncentracích se oxid chloričitý může explozivně rozkládat. Proto jej z bezpečnostních důvodů nelze přepravovat a připravuje se vždy na místě.
Ve vodárenství je výchozí surovinou pro výrobu oxidu chloričitého většinou vodný roztok chloritanu sodného. Z něho lze ClO2 uvolnit například
- reakcí s roztokem kyseliny, nejčastěji kyseliny chlorovodíkové
- 5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + 2 H2O
- reakcí s roztokem chloru, resp. s roztokem kyseliny chlorné, která vzniká spolu s kyselinou chlorovodíkovou po rozpuštění chloru ve vodě
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
- 2 NaClO2 + HClO + HCl → 2 ClO2 + 2 NaCl + H2O
- velmi čistý oxid chloričitý lze vyrobit i reakcí pevného chloritanu sodného s plynným chlorem
- reakcí s roztokem chlornanu sodného a kyseliny chlorovodíkové
- 2NaClO2 + NaClO + 2 HCl → 2 ClO2 + 3 NaCl + H2O
- reakcí s roztokem hydrogensíranu sodného
- 5 NaClO2 + 4 NaHSO4 → 4 ClO2 +4 Na2SO4 + NaCl + 2 H2O
Připravuje se roztok o koncentraci přibližně 3 g/l, který lze skladovat až jeden měsíc. Pro svoji technickou nenáročnost lze tento postup využít v lokalitách s předpokládanou malou spotřebou ClO2, kde by bylo neekonomické použít reaktory pro generování oxidu chloričitého. Lze vyjít i z krystalického chloritanu a hydrogensíranu sodného, čímž se zmenší objem přepravovaných surovin.
- elektrolýzou. Oxid chloričitý vzniká na anodě přenosem jednoho elektronu
- ClO−2 → ClO2 + e−
V průmyslových odvětvích kde je potřeba vyrobit velká množství oxidu chloričitého (bělení buničiny apod.) bývá výchozí surovinou chlorečnan sodný. Oxid chloričitý vzniká reakcí chlorečnanu s kyselinou sírovou za přítomnosti redukčního činidla, např. peroxidu vodíku
- 2 NaClO3+ H2SO4 + H2O2 → 2 ClO2 + O2 + Na2SO4 + 2 H2O
Laboratorně lze připravit oxid chloričitý reakcí roztoku chloritanu sodného s peroxodisíranem sodným
- 2 NaClO2 + Na2S2O8 → 2 ClO2 + 2 Na2SO4
Použití

Oxid chloričitý se primárně (z více než 95 %) používá pro bělení buničiny, ale své místo má při dezinfekci pitné vody ve veřejných zdrojích. Úpravna vody pro New York (na Niagarských vodopádech) poprvé použila oxid chloričitý v roce 1944, a to k odstranění fenolu. Použití oxidu chloričitého jako prostředku k dezinfekci pitné vody bylo ve větším měřítku zahájeno v roce 1956, kdy v belgickém Bruselu přešli od chloru k oxidu chloričitému. Oxid chloričitý se při úpravě vody často používá jako předběžný oxidant před vlastním chlorováním, aby se zničily nečistoty, které by při kontaktu s volným chlorem způsobovaly tvorbu trihalomethanů. Trihalomethany jsou vedlejší produkty chlorové dezinfekce vzniklé reakcí chloru s přirozeně se vyskytujícími organickými látkami v surové vodě a jsou podezřelé z karcinogenity. Oxid chloričitý je také lepší než chlor, pokud se pracuje v prostředí s pH nad 7, v přítomnosti amoniaku a aminů a/nebo pro likvidaci biofilmů ve vodovodních distribučních systémech. Oxid chloričitý se též používá jako biocid v mnoha procesech průmyslové úpravy vody, včetně vody do chladicích věží, vody pro různé technické účely a pro zpracování potravin. Oxid chloričitý je méně žíravý než chlor a je lepší pro eliminaci bakterií Legionella.
Reference
V tomto článku byl použit překlad textu z článku Chlorine dioxide na anglické Wikipedii.
- Chlorine dioxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- 'White's Handbook of Chlorination and Alternative Disinfectants, Fifth Edition '
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Oxid chloričitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid chloričitý na Wikimedia Commons - ClO2.cz - český web o oxidu chloričitém
- (anglicky) Hesselink, T.L. MD.; "Mechanisms of Toxicity of Chlorine Dioxide Against Malarial Parasites - An Overview; 06/09/2007
- (anglicky) Catalytic Chlorine Dioxide Generation
- (anglicky) Stabilized Chlorine Dioxide used for oral hygiene



