Kyselina amidosulfonová
Kyselina amidosulfonová (též amidosírová; IUPAC název je kyselina sulfamová) je anorganická sloučenina se vzorcem H3NSO3. Tato bezbarvá, ve vodě rozpustná látka má široké možnosti použití.
| Kyselina amidosulfonová | |
|---|---|
Kyselina amidosulfonová; vpravo v ionizovaném stavu | |
| Obecné | |
| Systematický název | kyselina sulfamová |
| Triviální název | kyselina amidosulfonová |
| Ostatní názvy | kyselina amidosírová |
| Latinský název | Acidum sulfamicum |
| Anglický název | Sulfamic acid |
| Německý název | Amidosulfonsäure |
| Sumární vzorec | H3NSO3 |
| Vzhled | tuhá látka |
| Identifikace | |
| Registrační číslo CAS | 5329-14-6 |
| EC-no (EINECS/ELINCS/NLP) | 226-218-8 |
| PubChem | 5987 |
| UN kód | 2967 |
| SMILES | O=S(=O)(O)N |
| InChI | 1S/H3NO3S/c1-5(2,3)4/h(H3,1,2,3,4) |
| Číslo RTECS | WO5950000 |
| Vlastnosti | |
| Molární hmotnost | 97,10 g/mol |
| Teplota rozkladu | 205 °C |
| Hustota | 2,15 g/cm3 |
| Rozpustnost ve vodě | částečná, s pomalou hydrolýzou |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H319 H315 H412 |
| R-věty | R36/38 R52/53 |
| S-věty | S2 S26 S28 S61 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Kyselinu amidosulfonovou lze považovat za přechodnou sloučeninu mezi kyselinou sírovou (H2SO4) a sulfamidem (H4N2SO2). Při každé reakci (z kyseliny sírové na amidosulfonovou, resp. dále na sulfamid) se nahrazuje hydroxylová skupina -OH aminoskupinou -NH2. Toto schéma už však nejde dál rozšířit žádným směrem, aniž by byla rozštěpena skupina -SO2.
Struktura a reaktivita
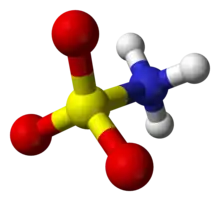
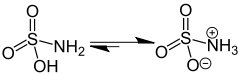
Sloučenina je správně popsána vzorcem H3NSO3, nikoli tautomerem H2NSO2(OH). Příslušné délky vazeb jsou 1,44 Å pro vazbu S=O a 1,77 Å pro S-N. Větší délka u vazby S-N je konzistentní s jednoduchou vazbou.[2] Navíc zkoumání pomocí neutronové difrakce lokalizovalo atomy vodíku - všechny jsou 1,03 Å daleko od atomu dusíku.[3]. V tuhé fázi lze molekulu kyseliny amidosulfonové popsat zwitterionovou formou - viz obrázek v infoboxu.
Kyselina amidosulfonová je středně silnou kyselinou, Ka = 0,101 (pKa = 0,995). Protože v tuhé fázi není hygroskopická, používá se jako standard v acidimetrii.
- H3NSO3 + NaOH → NaH2NSO3 + H2O
Dvojitou deprotonací v roztoku amoniaku lze získat [HNSO3]2−.
Kyselina sulfamová taje při 205 °C, při vyšších teplotách se rozkládá na H2O, SO3, SO2 a N2.[4]
Vodné roztoky jsou nestabilní a pomalu hydrolyzují na hydrogensíran amonný. Krystalická forma kyseliny sulfamové je však za běžných podmínek velmi stabilní.
S HNO2 reaguje kyselina sulfamová za uvolnění N2, kdežto s HNO3 vzniká N2O.
- HNO2 + H3NSO3 → H2SO4 + N2 + H2O
- HNO3 + H3NSO3 → H2SO4 + N2O + H2O
Chování H3NSO3 se v určitých ohledech podobá močovině, (H2N)2CO. V obou případech jsou aminoskupiny napojeny na centra odebírající elektrony, které se mohou účastnit delokalizovaných vazeb. Obě sloučenina při zahřátí ve vodě uvolňují amoniak.
Použití
Čisticí látka
Kyselina amidosulfonová se používá jako kyselá čisticí látka a to jak v čisté formě, tak jako složka různých směsí hlavně pro čištění kovů a keramiky. Často se používá na odstranění rzi a vodního kamene namísto těkavější a žíravé kyseliny chlorovodíkové, je běžnou složkou domácích přípravků na odstranění vodního kamene. Vytváří ve vodě rozpustné soli s vápenatými a železitými kationty.
Tato látka je pro použití v domácnostech vhodnější než kyselina chlorovodíková díky své bezpečnosti. Pokud se náhodou smísí s přípravky obsahujícími chlornany, jako např. bělidlo, neuvolňuje chlor jako v případě ostatních kyselin.
Ostatní použití
- katalyzátor esterifikačních reakcí
- výroba barev a barviv
- herbicid
- srážedlo močovino-formaldehydových pryskyřic
- složka hasicích přípravků (ve formě amonné soli)
- při výrobě papíru jako stabilizátor chloridů
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Sulfamic acid na anglické Wikipedii.
- Sulfamic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- J. W. Bats, P. Coppens, T. F. Koetzle "The Experimental Charge Density in Sulfur-Containing Molecules: A Study of the Deformation Electron Density in Sulfamic Acid at 78 K by X-ray and Neutron Diffraction" Acta Crystallographica 1977, B33, pages 37–45.
- R. L. Sass. A neutron diffraction study on the crystal structure of sulfamic acid. Acta Cryst.. 1960, s. 320–324. DOI 10.1107/S0365110X60000789. (anglicky)
- Katsumasa Yoshikubo & Michio Suzuki :Sulfamic Acid and Sulfamates, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2001
Literatura
- Sulfamates and their therapeutic potential. Med Res Rev. 2005 Mar;25(2):186-228. Review.
- R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina amidosulfonová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina amidosulfonová na Wikimedia Commons - MSDS www.osha.gov Archivováno 29. 5. 2010 na Wayback Machine
