Kovem katalyzovaná hydroborace
Kovem katalyzovaná hydroborace je druh reakce využívaný v organické syntéze; jedná se o příklad homogenní katalýzy.
Historie
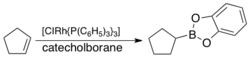
V roce 1975 oznámili H. Kono a K. Itó, že Wilkinsonův katalyzátor (Rh(PPh3)3Cl) může vstupovat do oxidačně-adičních reakcí s katecholboranem (HBcat) nebo 4,4,6-trimethyl-1,3,2-dioxaborinanem.[1] Tyto deriváty boranu reagují při hydroboracích příliš pomalu.[2][3]
V roce 1985 bylo zjištěno, že Wilkinsonův katalyzátor katalyzuje hydroborace alkenů pomocí HBcat.
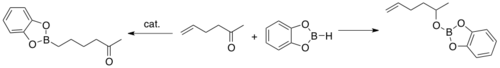
Zatímco nekatalyzované hydroborace pomocí HBcat vedou k redukci karbonylových skupin, tak katalyzované obdoby jsou selektivní vzhledem k alkenům.[4]
Dalším výzkumem se zjistilo, že hydroborace katalyzované přechodnými kovy se vyznačují regio-, stereo- a chemoselektivitou.
Mechanismus
Rhodiem katalyzované hydroborace pravděpodobně začínají odštěpením trifenylfosfinu z Rh+ centra. Po oxidační adici vazby B-H boranového reaktantu na vzniklou 14elektronovou molekulu následuje koordinace alkenu na 16elektronový komplex Rh3+. Následně se alken naváže na vazbu rhodium-hydrid, čímž se mohou vytvořit dva různé, navzájem regioizomerní, alkylrhodité boridové komplexy. Redukční eliminací boronátového esteru se obnoví katalyzátor. Katalyzátor, připravený a přechovávaný za nepřístupu vzduchu, posouvá selektivitu ve prospěch sekundárního boronátového esteru. Koordinace alkenu je stále předmětem diskuzí; v disociativním mechanismu, navrženém Männigem a Nöthem,[4] a podpořeným výsledky, které získali D. A. Evans a G. C. Fu;[5] koordinace je doprovázena oddělením jednoho trifenylfosfinového ligandu.
V níže znázorněném asociativním mechanismu[6] se alken váže do polohy trans vzhledem ke chloridu, aniž by docházelo k odštěpení trifenylfosfinu. Mechanismus byl prozkoumán pomocí výpočetních metod.[7][8]
A. E. Dorigo a P. R. Schleyer vyvrátili asociativní mechanismus na základě ab initio studie disociativního mechanismu,[9] zatímco D. G. Musaev jej podpořil.[10]
Selektivita
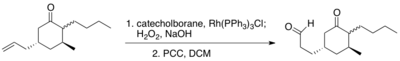
Mimo původní důkazy, které poskytli Männig a Nöth, ukazuje i totální syntéza (+)-ptilokaulinu selektivitu hydroborace koncových alkenů za přítomnosti ketonů.[11]
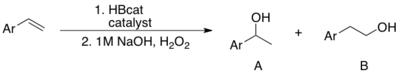
Z hlediska regioselektivity se katalyzované hydroborace liší od nekatalyzovaných. V závislosti na ligandech a alkenech mohou vznikat markovnikovské i nemarkovnikovské produkty. Rozdíly v regioselektivitě jsou výraznější u hydroborací vinylarenů s použitím HBcat. Wilkinsonův katalyzátor a Rh(COD)2 (za přítomnosti PPh3) vytváří markovnikovovský produkt.[12][13] Protimarkovnikovovský produkt se tvoří za nepřítomnosti katalyzátoru.[14]
Použití RhCl3·nH2O vedlo také k selektivní tvorbě protimarkovnikovského produktu.[15]
Za účelem vysvětlení vysoké regioselektivity katalyzovaných hydroborací byl navržen mechanismus zahrnující η3-benzylrhodiový komplex.[12]
Katalyzované hydroborace-oxidace substituovaných alkenů lze provést enantioselektivně. V roce 1990 provedl J. M. Brown asymetrické hydroborace pomocí nechirálního katalyzátoru a chirálních boranů odvozených od efedrinu a pseudoefedrinu. Ve většině případů byla regioselektivita nízká, i když enantiomerní přebytky dosahovaly až 90 %.[16]
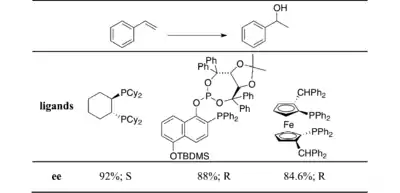
Použití chirálních katalyzátorů a nechirálních boranů je častější, jako příklad lze uvést chirální difosfiny, jako je BINAP.[17][18][19]
Styren nebo jeho jednodušší deriváty slouží obvykle jako prochirální substráty.[20][21][22]
Enantioselektivita se snižuje, pokud jsou na aromatický kruh navázány substituenty do polohy ortho, nebo při další substituci alkenové skupiny.
Úspěchy byly dosaženy také s jinými reaktanty.[23][24]
Další používanou skupinou ligandů jsou fosfinaminy. V roce 1993 bylo popsáno první úspěšné použití sloučeniny QUINAP při asymetrické hydroboraci alkenu.[25]
QUINAP umožňuje se vypořádat s nemožností využití substituce na aromatickém kruhu pozorovanému u difosfinových ligandů. Reakce, při nichž jsou použity styren nebo od něj odvozené sloučeniny se skupinami dodávajícími elektrony na pozici para vykazují stále vysoké enantiomerní přebytky. Podobných výsledků lze dosáhnout i u cyklických vinylarenů. Tyto výsledky rozšiřují využitelnost asymetrické hydroborace na více stericky zatížené alkeny. Bylo vyvinuto i několik nových ligandů z této skupiny.[26][27][28]
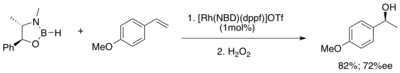
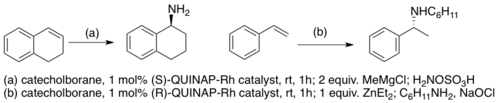
Výše uvedené studie zkoumaly oxidace boronátových esterů na alkoholy. Další významnou skupinou sloučenin, které lze připravit z boronátových esterů jsou α-substituované benzylaminy, některé z nich mají komerční využití. Příprava chirálních aminů pomocí katalytických hydroborací zahrnuje přeměnu katecholboronátových esterů na trialkylborany pomocí diethylzinku nebo methylmagnesiumchloridu. Reakce trialkylboranu s kyselinou hydroxylamin-O-sulfonovou vede ke vzniku primárních benzylaminů.[29]
Sekundární aminy lze získat in situ z N-chloraminů.[30]
Reference
V tomto článku byl použit překlad textu z článku Metal-catalysed hydroboration na anglické Wikipedii.
- H. Kono; K. Ito. Oxidative Addition Of 4,4,6-Trimethyl-1,3,2-Dioxaborinane And Benzo[1,3,2]Dioxaborole To Tris (Triphenylphosphine)Halogenorhodium. Chemistry Letters. 1975, s. 1095–1096. DOI 10.1246/cl.1975.1095.
- H. C. Brown; S. K. Gupta. 1,3,2-Benzodioxaborole, a convenient monofunctional hydroborating agent. Simple new synthesis of alkaneboronic esters and acids from olefins via hydroboration. Journal of the American Chemical Society. 1971, s. 1816–1818. DOI 10.1021/ja00736a061.
- R. H. Fish. Relative rates of hydroboration of several olefins with 4,4,6-trimethyl-1,3,2-dioxaborinane. Journal of Organic Chemistry. 1973, s. 158–159. DOI 10.1021/jo00941a037.
- D. Männing; H. Nöth. Catalytic Hydroboration with Rhodium Complexes. Angewandte Chemie International Edition. 1985, s. 878–879. DOI 10.1002/anie.198508781.
- D. A. Evans; G. C. Fu; B. A. Anderson. Mechanistic study of the rhodium(I)-catalyzed hydroboration reaction. Journal of the American Chemical Society. 1992, s. 6679–6685. DOI 10.1021/ja00043a010.
- K. Burgess; W. A. Van der Donk; S. A. Westcott; T. B. Marder; R. Thomas Baker; J. C. Calabrese. Reactions of Catecholborane with Wilkinson's Catalyst:Implications for Transition Metal-Catalyzed Hydroborations of Alkenes. Journal of the American Chemical Society. 1992, s. 9350–9359. DOI 10.1021/ja00050a015.
- C. Widauer; H. Grützmacher; T. Ziegler. Comparative Density Functional Study of Associative and Dissociative Mechanisms in the Rhodium(I)-Catalyzed Olefin Hydroboration Reactions. Organometallics. 2000, s. 2097–2107. DOI 10.1021/om9909946.
- X. Huang; Z. Y. Lin. Computational Modeling of Homogeneous Catalysis. New York: Kluwer Academic Publishers, 2002. ISBN 1-4020-0933-X. S. 189–212.
- A. E. Dorigo; P. R. Schleyer. An Ab Initio Investigation of the RhI-Catalyzed Hydroboration of C=C Bonds: Evidence for Hydrogen Migration in the Key Step. Angewandte Chemie International Edition. 1995, s. 115–118. DOI 10.1002/anie.199501151.
- D. G. Musaev; A. M. Mebel; K. Morokuma. An ab initio molecular orbital study of the mechanism of the rhodium(I)-catalyzed olefin hydroboration reaction. Journal of the American Chemical Society. 1994, s. 10693–10702. DOI 10.1021/ja00102a039.
- C. Janine; S. BouzBouz. A Short Access to (+)-Ptilocaulin. Tetrahedron Letters. 1996, s. 5091–5094. DOI 10.1016/0040-4039(96)01032-5.
- T. Hayashi; Y. Matsumoto; Y. Ito. Asymmetric hydroboration of styrenes catalyzed by cationic chiral phosphine-rhodium(I) complexes. Tetrahedron: Asymmetry. 1991, s. 601–612. DOI 10.1016/S0957-4166(00)86112-1.
- J. Zhang; B. Lou; G. Guo; L. Dai. Reversed regiochemistry in the hydroboration of vinylarenes catalyzed by neutral rhodium complexes and the related asymmetric version. Journal of Organic Chemistry. 1991, s. 1670–1672. DOI 10.1021/jo00004a060.
- A. Pelter; K. Smith. Comprehensive Organic Chemistry, Vol. III. New York: Pergamon Press, 1979.
- T. C. Morrill; C. A. D'Souza; L. Yang; A. J. Sampognaro. Transition-Metal-Promoted Hydroboration of Alkenes: A Unique Reversal of Regioselectivity. Journal of Organic Chemistry. 2002, s. 2481–2484. DOI 10.1021/jo0109321.
- J. M. Brown; G. C. Lloyd-Jones. Catalytic Asymmetric Hydroboration with Oxazaborolidines. Tetrahedron:Asymmetry. 1990, s. 869–872. DOI 10.1016/S0957-4166(00)82276-4.
- T. Hayashi; Y. Matsumoto; Y. Ito. Catalytic asymmetric hydroboration of styrenes. Journal of the American Chemical Society. 1989, s. 3426–3428. DOI 10.1021/ja00191a049.
- K. Burgess; M. J. Ohlmeyer. Enantioselective hydroboration mediated by homochiral rhodium catalysts. Journal of Organic Chemistry. 1988, s. 5178–5179. DOI 10.1021/jo00256a059.
- M. Sato; N. Miyaura; A. Suzuki. Rhodium(i)-catalyzed asymmetric hydroboration of alkenes with 1,3,2-benzodioxaborole. Tetrahedron Letters. 1990, s. 231–234. DOI 10.1016/S0040-4039(00)94379-X.
- S. Demay; F. Volant; P. Knochel. New C2-Symmetrical 1,2-Diphosphanes for the Efficient Rhodium-Catalyzed Asymmetric Hydroboration of Styrene Derivatives. Angewandte Chemie International Edition. 2001, s. 1235. DOI 10.1002/1521-3773(20010401)40:7<1235::aid-anie1235>3.0.co;2-y.
- F. Blume; S. Zemolka; T. Fey; R. Kranich; H. G. Schmalz. Identification of Suitable Ligands for a Transition Metal-Catalyzed Reaction: Screening of a Modular Ligand Library in the Enantioselective Hydroboration of Styrene. Advanced Synthesis & Catalysis. 2002, s. 868. DOI 10.1002/1615-4169(200209)344:8<868::aid-adsc868>3.0.co;2-m.
- M. T. Reetz; E. W. Beuttenmuller; R. Goddard; M. Pasto. A new class of chiral diphosphines having planar chirality. Tetrahedron Letters. 1999, s. 4977–4980. DOI 10.1016/S0040-4039(99)00947-8.
- R. Rubina; M. Rubin. Catalytic Enantioselective Hydroboration of Cyclopropenes. Journal of the American Chemical Society. 2003, s. 7198–7199. DOI 10.1021/ja034210y. PMID 12797792.
- A. Perez Luna; M. Bonin; L. Micouin; H.-P. Husson. Reversal of Enantioselectivity in the Asymmetric Rhodium- versus Iridium-Catalyzed Hydroboration of Meso Substrates. Journal of the American Chemical Society. 2002, s. 12098–12099. Dostupné online. DOI 10.1021/ja026714m.
- N. W. Alcock; J. M. Brown; D. I. Hulmes. Synthesis and resolution of 1-(2-diphenylphosphino-1-naphthyl)isoquinoline; a P,N chelating ligand for asymmetric catalysis. Tetrahedron: Asymmetry. 1993, s. 743–756. DOI 10.1016/S0957-4166(00)80183-4.
- R. J. Kloetzing; M. Lotz; P. Knochel. New P,N-ferrocenyl ligands for rhodium-catalyzed hydroboration and palladium-catalyzed allylic alkylation. Tetrahedron: Asymmetry. 2003, s. 255–264. DOI 10.1016/S0957-4166(02)00827-3.
- F. Y. Kwong; Q. C. Yang; T. C. W. Mak; A. S. C. Chan; K. S. Chan. A New Atropisomeric P,N Ligand for Rhodium-Catalyzed Asymmetric Hydroboration. Journal of Organic Chemistry. 2002, s. 2769–2777. DOI 10.1021/jo0159542.
- S. U. Son; H. Y. Jang; J. W. Han; I. S. Lee; Y. K. Chung. New planar chiral P,N-ligands containing tricarbonyl(arene)chromium for enantioselective asymmetric hydroboration of styrenes. Tetrahedron Asymmetry. 1999, s. 347–354. DOI 10.1016/S0957-4166(99)00005-1.
- E. Fernandez; M. W. Hooper; F. I. Knight; J. M. Brown. Catalytic asymmetric hydroboration–amination. Chemical Communications. 1997, s. 173. DOI 10.1039/A606827H.
- E. Fernandez; K. Maeda; M. W. Hooper; J. M. Brown. Catalytic Asymmetric Hydroboration/Amination and Alkylamination with Rhodium Complexes of 1,1′-(2-Diarylphosphino-1-naphthyl)isoquinoline. Chemistry: A European Journal. 2000, s. 1840. DOI 10.1002/(sici)1521-3765(20000515)6:10<1840::aid-chem1840>3.0.co;2-6.