Diethylzinek
Diethylzinek (zkráceně DEZ) je organická sloučenina se vzorcem (C2H5)2Zn, jedná se o vysoce samozápalnou organozinečnatou sloučeninu obsahující centrum tvořené atomem zinku, na nějž jsou navázány dvě ethylové skupiny. Používá se jako reaktant v organické chemii; dostupný je jak jako roztok v hexanu, heptanu či toluenu, tak i v čisté podobě jako bezbarvá kapalina.
| Diethylzinek | |
|---|---|
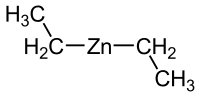
Strukturní vzorec | |
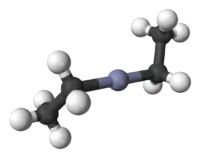
Model molekuly | |
| Obecné | |
| Systematický název | diethylzinek |
| Funkční vzorec | (C2H5)2Zn |
| Sumární vzorec | C4H10Zn |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 557-20-0 |
| EC-no (EINECS/ELINCS/NLP) | 209-161-3 |
| PubChem | 11185 |
| SMILES | C[CH2-].C[CH2-].[Zn+2] |
| InChI | 1S/2C2H5.Zn/c2*1-2;/h2*1H2,2H3;/q2*-1;+2 |
| Vlastnosti | |
| Molární hmotnost | 123,53 g/mol |
| Teplota tání | −28 °C (245 K)[1] |
| Teplota varu | 118 °C (391 K)[1] |
| Hustota | 1,207 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | nebezpěčně reaguje |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v petroletheru, benzenu a diethyletheru[1] |
| Tlak páry | 2,78 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H250 H260 H314 H318 H400 H410}[1] |
| P-věty | P210 P222 P223 P231+232 P233 P240 P241 P242 P243 P260 P264 P273 P280 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P310 P321 P335+334 P363 P370+378 P391 P402+404 P403+235 P405 P422 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava a výroba
Edward Frankland popsal v roce 1848 přípravu této sloučeniny z kovového zinku a jodethanu, jednalo se o první známou organozinečnatou sloučeninu.[2][3] Přípravu poté vylepšil použitím diethylrtuti jako výchozího materiálu.[4] V současnosti se vyrábí reakcí směsi jodethanu a bromethanu v molárním poměru 1 : 1 za přítomnosti slitiny zinku a mědi jako zdroje reaktivního zinku.[5]
Struktura
Diethylzinek krystalizuje v tetragonální bazálně centrované elementární buňky s grupami symetrie typu I41md. V pevném skupenství jsou Zn centra téměř lineární. Délka vazeb Zn-C činí 194,8(5) pm, vazebné úhly C-Zn-C mají hodnoty 176,2(4)°.[6] Plynná fáze vykazuje obdobné vzdálenosti Zn-C (195,0(2) pm).[7]
Použití
I přesto, že se snadno samovznítí, tak je diethylzinek významným reaktantem. Používá se v organické syntéze jako zdroj ethylových karboaniontů při adicích na karbonylové skupiny a asymetrických adicích ethylových skupin na benzaldehyd[8] a iminy.[9] Navíc může sloužit společně s dijodmethanem jako složka Simmonsova–Smithova činidla k přeměně alkenů na cyklopropylové sloučeniny.[10][11] Je slabším nukleofilem než alkyllithná a Grignardova činidla, a používá se tak v případech, kdy je potřeba „mírnější“ nukleofil. Tato sloučenina má také široké využití v materiálové chemii jako zdroj zinku při přípravě nanočástic, například slouží k tvorbě vrstev sulfidu zinečnatého na kvantových tečkách.[12] V polymerní chemii jej lze použít jako část katalyzátoru pro živé polymerizace.[13]
Diethylzinek má i nechemická využití. Vzhledem k rychlé reakci se vzduchem byl používán jako krátkodobé samozápalné raketové palivo, které se při styku s oxidačním činidlem zapálí, takže k zapálení paliva nebyl potřebný zdroj jisker. Diethylzinek byl také zkoumán jako možný prostředek k odkyselování knih. Páry diethylzinku mohou neutralizovat pozůstatky kyselin v papíru, přičemž zanechávají mírně zásaditý oxid zinečnatý. Postup nakonec nebyl zaveden kvůli řadě nežádoucích projevů, například několika výbuchům při styku stopových množství diethylzinku s vodní parou.[14]
K protikorozní ochraně lehkovodních jaderných reaktorů se používá oxid zinečnatý ochuzený o 64Zn, vyráběný průchodem diethylzinku obohacovací odstředivkou.
Samozápalnost diethylzinku lze využít k otestování inertní atmosféry v rukavicovém boxu. Při i velmi nízkých koncentracích kyslíku začne otevřená láhev diethylzinku dýmat.[15]
Bezpečnost
Diethylzinek nebezpečně reaguje s vodou a na vzduchu je samozápalný, měl by tak být skladován v inertním prostředí.
Odkazy
Externí odkazy
- Ukázka samovznícení diethylzinku na vzduchu Video – University of Nottingham
Reference
V tomto článku byl použit překlad textu z článku Diethylzinc na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/11185
- E. Frankland. On the isolation of the organic radicals. Quarterly Journal of the Chemical Society. 1850, s. 263. Dostupné online. DOI 10.1039/QJ8500200263. (anglicky)
- Dietmar Seyferth. Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry. Organometallics. 2001, s. 2940–2955. DOI 10.1021/om010439f. (anglicky)
- E. Frankland, B. F. Duppa. On a new reaction for the production of the zinc-compounds of the alkyl-radical. Journal of the Chemical Society. 1864, s. 29–36. Dostupné online. DOI 10.1039/JS8641700029. (anglicky)
- C. R. NOLLER. Diethyl Zinc. Org. Synth.. 1943. Dostupné online. (anglicky); Coll. Vol.. S. 184. (anglicky)
- John Bacsa; FELIX HANKE; SARAH HINDLEY; RAJESH ODEDRA; GEORGE R. DARLING; ANTHONY C. JONES; ALEXANDER STEINER. The Solid State Structures of Dimethylzinc and Diethylzinc. Angewandte Chemie International Edition. 2011, s. 11685–11687. DOI 10.1002/anie.201105099. PMID 21919175. (anglicky)
- A. Haaland; J. C. GREEN; G. S. MCGRADY; A. J. DOWNS; E. GULLO; M. J. LYALL; J. TIMBERLAKE. The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy. Dalton Transactions. 2003, s. 4356–4366. DOI 10.1039/B306840B. (anglicky)
- MASATO KITAMURA, HIROMASA OKA, SEIJI SUGA, AND RYŌJI NOYORI. Catalytic Enantioselective Addition of Dialkylzincs to Aldehydes Using (2S)-(−)-3-exo-(Dimethylamino)isoborneol [(2S)-DAIB]: (S)-1-Phenyl-1-propanol. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 635. (anglicky)
- JEAN-NICOLAS DESROSIERS, ALEXANDRE CÔTÉ, ALESSANDRO A. BOEZIO, AND ANDRÉ B. CHARETTE. Preparation of Enantiomerically Enriched (1S)-1-Phenylpropan-1-amine Hydrochloride by a Catalytic Addition of Diorganozinc Reagents to Imines. Org. Synth.. 2005, s. 5. Dostupné online. (anglicky)
- ANDRÉ B. CHARETTE AND HÉLÈNE LEBEL. (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 613. (anglicky)
- YOSHIHIKO ITO, SHOTARO FUJII, MASASHI NAKATUSKA, FUMIO KAWAMOTO, AND TAKEO SAEGUSA. One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one. Org. Synth.. 1988. Dostupné online. (anglicky); Coll. Vol.. S. 327. (anglicky)
- Dmitri V. Talapin; IVO MEKIS; STEPHAN GÖTZINGER; ANDREAS KORNOWSKI; OLIVER BENSON; HORST WELLER†. CdSe/CdS/ZnS and CdSe/ZnSe/ZnS Core−Shell−Shell Nanocrystals. Journal of Physical Chemistry B. 2004, s. 18826–18831. DOI 10.1021/jp046481g. (anglicky)
- Mitsuo Sawamoto; CHIHIRO OKAMOTO; TOSHINOBU HIGASHIMURA. Hydrogen iodide/zinc iodide: a new initiating system for living cationic polymerization of vinyl ethers at room temperature. Macromolecules. 1987, s. 2693–2697. DOI 10.1021/ma00177a010. (anglicky)
- Kenneth E. Harris; CHANDRU J. SHAHANI. Mass Deacidification: An Initiative To Refine The Diethyl Zinc Process. Washington, D.C.: Library of Congress, 2004. Dostupné v archivu pořízeném z originálu dne 2013-05-14. (anglicky)
- SHRIVER, Duward F.; DREZDZON, Mark A. The Manipulation of Air-Sensitive Compounds. [s.l.]: John Wiley & Sons, 1986. ISBN 0-471-86773-X. S. 57. (anglicky)


