Nukleofilní konjugovaná adice
Nukleofilní konjugovaná adice je druh organické reakce, zvláštní případ nukleofilní adice. Běžné nukleofilní adice probíhají většinou u karbonylových sloučenin. Jednodušší alkenové sloučeniny nevykazují 1,2-reaktivitu kvůli chybějící polaritě, pokud alkeny nejsou aktivovány zvláštními substituenty. U α,β-nenasycených karbonylových sloučenin jako je cyklohexenon lze z rezonančních struktur odvodit, že β pozice je elektrofilním místem, které může reagovat s nukleofilem. Záporný náboj je v těchto strukturách tvořen alkoxidovým aniontem. Taková nukleofilní adice se nazývá nukleofilní konjugovaná adice nebo 1,4-nukleofilní adice. Nejdůležitějšími aktivovanými alkenovými sloučeninami jsou výše zmíněné karbonylové sloučeniny a také akrylonitrily.
Reakční mechanismus
Konjugovaná nukleofilní adice je vinylogním protějškem přímé nukleofilní adice. Nukleofil reaguje s α,β-nenasycenou karbonylovou sloučeninou na β pozici. Záporný náboj nukleofilu je nyní delokalizován v alkoxidovém aniontu a α uhlíkovém karboaniontu. Protonace probíhá přes keto-enol tautomerii k nasycené karbonylové sloučenině. Při vicinální difunkcionalizaci je proton nahrazen jiným elektrofilem.
Reakce
- Konjugované karbonyly reagují se sekundárními aminy za vzniku 3-aminokarbonylových sloučenin (3-ketoaminů), například konjugovanou adicí methylaminu na cyklohexen-2-on vzniká 3-(N-methylamino)-cyklohexanon.
- Konjugované karbonyly reagují s kyanovodíkem za vzniku 1,4-ketonitrilů.
- Gilmanova činidla jsou účinnými nukleofily pro 1,4-adice na konjugované karbonyly
- Michaelova reakce zahrnuje adici enolátu na konjugované karbonylové sloučeniny.
- Storkova enaminová reakce zahrnuje adici enaminů na konjugované karbonylové sloučeniny.
Přehled
Konjugovaná adice je užitečná pro tvorbu nových vazeb uhlík-uhlík za pomoci organokovových činidel, například reakcí organojodidů zinku s methylvinylketonem.
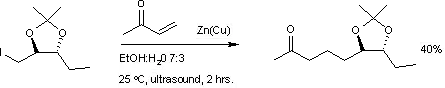
Příkladem asymetrické syntézy za použití konjugované nukleofilní adice je syntéza (R)-3-fenyl-cyklohexanonu z cyklohexenonu, kyseliny fenylborité a chirálního ligandu BINAP (katalyzátorem je acetylacetonát rhodia).
-3-phenyl-cyclohanone.png.webp)
V dalším příkladu asymetrické syntézy nejprve α,β-nenasycená karbonylová sloučenina reaguje s chirálním imidazolidinonovým katalyzátorem a další chirální látkou za vzniku iminiové sloučeniny alkylimino-de-oxo-bisubstitucí; tato sloučenina následně enantioselektivně reaguje s furanovým nukleofilem, čímž se utvoří enamin, následuje kaskáda reakcí, při níž je odstraněn chlor z chlorovaného chinonu. Po odstranění aminového katalyzátoru je keton efektivně funkcionalizován.
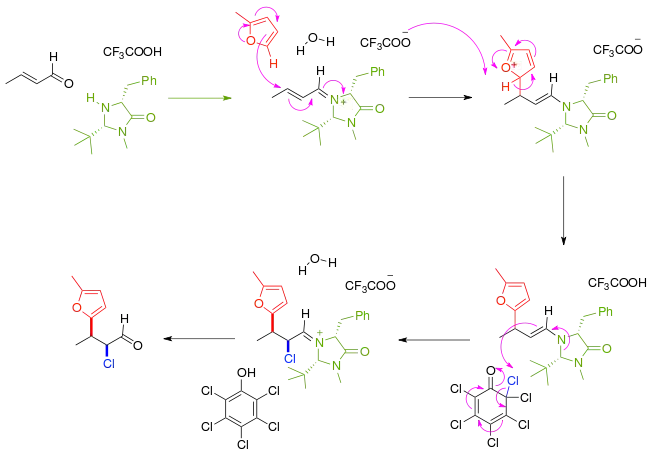
Tento princip je také využíván při enantioselektivní vícesložkové dominové konjugované adici nukleofilních thiolů jako je benzylthiol na elektrofilní diethylazodikarboxylát.

Toxikologie
Rozpustné Michaelovy akceptory jsou toxické, jelikož alkylují DNA konjugovanou adicí. Některé takto způsobené změny vyvolávají mutace, což má cytotoxické a karcinogenní účinky. S těmito látkami ovšem mohou rovněž reagovat glutathion a dimethylfumarát.
Reference
V tomto článku byl použit překlad textu z článku Nucleophilic conjugate addition na anglické Wikipedii.