Izotyp
Izotyp je používáno jako označení pro třídu či skupinu protilátek se stejnou konstantní částí (Fc fragmentem). Izotyp je určen konstantní částí těžkých řetězců protilátky. Izotyp určuje funkci protilátky, konstantní část zprostředkovává vazbu na receptory a může vytvářet multimery. Produkovaný izotyp protilátek je určen stupněm maturace B-buňky.[1]

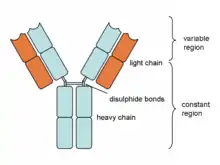
Lidské imunoglobuliny lze rozdělit do 5 izotypových tříd: IgM, IgD, IgG, IgE a IgA. IgG lze dále rozdělit na 4 subtypy (IgG1-4) a IgA na dva (IgA1 a IgA2).
Nezralé B-buňky produkují nativně protilátkové izotypy IgM a IgD. K přesměrování produkce na jinou třídu dochází vlivem signálů z prostředí a molekulární mechanismus k tomu využívaný se nazývá izotypový přesmyk.[1]
Struktura
Těžký řetězec protilátky je tvořen jednou variabilní imunoglobulinovou doménou na N-konci proteinu a třemi až čtyřmi konstantními imunoglobulinovými doménami na C-konci. Protilátky se třemi konstantními doménami mívají mezi první a druhou konstantní doménou oblast takzvaného "pantu" (z angl. "hinge"), flexibilnější oblast dávající protilátce charakteristický tvar písmene Y.[2]
Izotypy IgM a IgA mohou tvořit multimery. V případě IgM jsou to typicky pentamery, ale může docházet i k tvorbě hexamerů. IgA se běžně vyskytuje ve formě monomerů a dimerů, vzácněji může tvořit i tetramery. Multimerizace zvyšuje aviditu protilátkového komplexu a je zvlášť důležitá v slizniční imunitě. Pro tvorbu multimerů je důležitý J-řetězec. J-řetězec je malý protein, který pomocí disulfidických můstků váže C-konce jednotlivých protilátek. V multimeru se vyskytuje vždy jen jeden J-řetězec, nezávisle na počtu protilátek.[3]
Genetika
Lidský lokus pro těžké řetězce protilátek se nachází na dlouhém raménku chromozomu 14, konkrétně v oblasti 14q32. Za skupinou genových segmentů (po směru transkripce), ze kterých se vytváří variabilní doména, se nachází 9 funkčních exonů pro konstantní část.[4] Segmenty kódující konkrétní konstantní části se označují řeckým písmenem korespondujícím s výsledným izotypem - například pro IgM se používá segment Cμ, pro IgD segment Cδ a pro IgG1 segmment Cγ1.[4]
Alternativním sestřihem lze každý těžký řetězec vyrobit buď transmembránový, nebo volný. Transmembránově kotvené protilátky slouží produkující B-buňce jako B-receptor, volné protilátky jsou sekretované a plní svou funkci v oběhu.[4]
Prvními exony pro konstantní část těžkého řetězce jsou Cμ a Cδ. U naivních B-buněk tak dochází k expresi IgM a IgD. Oba genové segmenty jsou přepisovány na jeden transkript mRNA a k určení izotypu protilátky dochází alternativním sestřihem.[4][5] Buňka tak může exprimovat na svém povrchu obě varianty zároveň. Pro přesměrování na jiný izotyp se využívá mechanismus izotypového přesmyku, kdy dochází k nevratnému vystřižení DNA[5]. Buňka poté exprimuje pouze jeden izotyp protilátek a nemůže se již vrátit k produkci IgM a IgD.
Mezi exony kódujícími konstantní části protilátky se nachází repetitivní oblasti důležité pro rekombinaci a izotypový přesmyk. Nazývají se "switch" oblasti podle anglického slova pro výměnu. Před každým exonem pro konstantní část těžkého řetězce (s výjimkou Cδ, jelikož IgD se tvoří jiným mechanismem) je jedna switch oblast.[1][5][6]
Izotypový přesmyk
Mechanizmus, který B-buňka využívá ke změně izotypu produkovaných protilátek, se nazývá izotypový přesmyk. Dochází k němu pouze u aktivovaných B-buněk, tedy u těch, které se setkali se specifickým antigenem.[1]
V reakci na signály z prostředí a okolních buněk, hlavně cytokiny, dojde k aktivaci enzymu AID (Activation-induced cytidine deaminase). AID deaminuje cytosin na uracil v cílových switch oblastech. Nekomplementární uracil je rozpoznaný a při působení DNA opravných mechanizmů může dojít k vytvoření dvouvláknových zlomů před aktuálním C segmentem (většinou Cμ) a cílovým C segmentem. Repetitivní switch oblasti před C segmenty spolu rekombinují a úsek DNA mezi nimi je vyštěpen ve formě kruhové molekuly. Nyní po exonech pro variabilní část těžkého řetězce následuje již cílový C segment a B-buňka vytváří cílový izotyp.[5]
Lidské izotypy imunoglobulinů
IgM
Tento izotyp protilátek začne naivní (nestimulovaná) B-buňka produkovat jako první, je následován izotypem IgD. Plasma dospělého člověka obsahuje méně než 10 % IgM.[1] Jelikož je tento izotyp produkován nezralými B-buňkami a neprošel afinitní maturací, nemusí být afinita těchto protilátek zvlášť vysoká. IgM je tedy pro zvýšení vázání na antigen sekretováno jako multimer, nejčastěji pentamer. Konstantní část těžkého řetězce IgM obsahuje čtyři imunoglobulinové domény, z nichž poslední zprostředkovává multimerizaci disulfidickými vazbami mezi monomery a J řetězcem.[6] Funkcí IgM je opsonizace a neutralizace antigenů. IgM také dobře aktivuje komplementovou kaskádu. Pentamerní struktura zvyšuje účinnost těchto procesů.[1][6]
IgM je jako první izotyp sekretovaný v reakci na stimulaci imunitního systému používané jako ukazatel akutní infekce.[6] Jedná se o typ protilátek, který je transportován přes epiteliální vrstvu, tvoří tak určitý podíl protilátek na mukózních površích.[3]
IgD
Spolu s IgM se IgD vyskytuje na povrchu naivních B-buněk. Dochází i k jeho sekreci do séra v malém množství, ale tento izotyp je citlivý k proteolýze a tak jsou jeho hodnoty v séru zanedbatelné. Jeho funkce je zatím nejasná.[6]
IgG
Tento izotyp je nejvíce zastoupen v séru dospělých lidí, difunduje do tkání, kde plní svou funkci. Dělí se na čtyři subtypy, označené 1-4 podle zastoupení v séru. Liší se schopností opsonizace, aktivace komplementu a vazbou na receptory.[1]
IgG1 je v séru nejvíce. Tento subtyp dobře opsonizuje, neutralizuje a fixuje komplement. Je přenášen přes placentu od matky k plodu. Váže se na všechny třídy Fcγ receptorů. IgG1 protilátky bývají indukovány nejčastěji v reakci na rozpoznání proteinových antigenů.[6]
IgG2 subtyp protilátek dobře neutralizuje antigeny, ale špatně fixuje komplement. V malé míře se přenáší v těhotenství přes placentu. Váže se jen na FcγRII. Tento subtyp IgG se nejčastěji vytváří v reakci na polysacharidové antigeny.[1][6]
IgG3 dobře opsonizuje i neutralizuje antigeny, nejlépe ze všech subtypů spouští komplementovou kaskádu. Je transportován přes placentu. Váže všechny třídy Fcγ receptorů. Vytváří se v reakci na proteinové antigeny.[1][6]
IgG4 je nejméně zastoupený subtyp. Hůře opsonizuje a neutralizuje oproti ostatním subtypům a neaktivuje komplement. Váže se na receptory s nízkou afinitou oproti ostatním subtypům. Vytváří se v reakci na polysacharidové antigeny.[6] Tento izotyp je citlivější na redukci centrální pantové oblasti. Může tedy docházet k rozpadání dvou těžkých řetězců od sebe a znovu ke složení bispecifických (se dvěma specifitami) protilátek. IgG4 protilátky jsou asociované s Th2 odpovědí, tedy alergickou reakcí, ale na rozdíl od IgE se vytváří při dlouhodobé expozici antigenu a nespouštějí pro alergii typické buněčné mechanismy. Výsledný efekt je sice mírně alergický, ale výrazně tolerogenní.[7][8]
IgA
IgA je po IgG druhý nejzastoupenější izotyp v séru. Na mukózních površích a v sekretech, jako je mateřské mléko či sliny, je nejzastoupenějším a nejdůležitějším izotypem. Například může tvořit až 50 % proteinu v kolostru. IgA se dělí na dva subtypy, IgA1 a IgA2.[1][6]
IgA1 tvoří až 84 % IgA v séru, také je hojně zastoupen v sekretech dýchací soustavy. Tento subtyp má oproti druhému delší oblast pantu, je tedy citlivější k proteolýze.[3] IgA2 je vytvářeno hlavně pro sekreci na mukózní povrchy reprodukčího ústrojí a do tlustého střeva, oproti druhému subtypu je stabilnější a více rezistentní vůči bakteriální proteolýze.[3][6] Podíly obou subtypů v sekretovaných tekutinách jsou značně variabilní, podle zdroje sekretu.[3]
Jeho struktura se liší podle toho, jestli je produkován do séra, nebo na mukózu. V séru se vyskytuje ve formě monomerů. Na mukózní povrchy je IgA dopravováno ve formě dimeru, výjimečně tetrameru. Monomery jsou spojeny pomocí J-řetězce, zároveň má 50 % až 90 % multimerních molekul navázanou extracelulární část polymerního Ig receptoru (pIgR), takzvanou sekretorickou komponentu (SC, z anglického Secretory Component). Na jeden dimer připadá jeden J-řetězec a jedna SC.[3]
Účelem IgA je hlavně neutralizace a opsonizace antigenů, jak virových, tak bakteriálních. IgA molekuly jsou glykosylované, aby ještě více vyvázaly patogeny a znemožnili jejich vazbě na epitel. IgA se dobře váže na mukus, opsonizované antigeny jsou pak spolu s tokem mukusu eliminovány. IgA má slabou schopnost aktivovat komplement, na mukózních površích se však většina složek komplementu nevyskytuje, tedy aktivace komplementu není důležitou funkcí IgA.[3]
IgE
IgE je v séru přítomné v nejnižší koncentraci ze všech izotypů. Je typicky vytvářen při Th2 odpovědi na parazitární infekce, ale také při alergických reakcích. Neopsonizuje ani neneutralizuje antigeny, neaktivuje komplement. Jeho funkcí je aktivace specifických buněčných typů, hlavně žírných buněk, bazofilů a eozinofilů. Na ně se váže s vysokou afinitou přes receptor IgεRI, tato vazba indukuje další expresi receptoru.[6]
IgE obsahuje čtyři imunoglobulinové domény v konstantní části těžkého řetězce.[6]
Evoluce izotypů u obratlovců
Aspekty adaptivního imunitního systému, kam protilátková odpověď patří, lze najít u všech obratlovců. Protilátky jako takové lze však nalézt až u čelistnatců (Gnathostomata).[9][10]
Hned u paryb se vyskytují tři různé izotypy, kódované mnoha genovými shluky.[9] Protilátky paryb mívají nízkou afinitu a specifitu k antigenu. Jedna B-buňka vytváří pouze jeden izotyp protilátek, bez možnosti přesmyku. IgM paryb odpovídá lidskému IgM. IgNAR je izotyp vyskytující se pouze u paryb. Je zvláštní tím, že je tvořen jen těžkými řetězci, bez lehkých řetězců.[10] Třetím izotypem u paryb je IgW (jinak nazýván i IgX, IgR, IgNARC), který má dvě formy, krátkou a dlouhou, tvořené alternativním sestřihem.[10]
U paprskoploutvých ryb byly nalezeny dva izotypy. Prvním je IgM, tento rybí izotyp odpovídá funkcí i organizací na genomu lidskému IgM. Druhým nalezeným izotypem u ryb je IgD, které je taktéž homologní s lidským IgD. Steně jako lidské IgD se přepisuje s IgM ale sestřih rybího a lidského IgD se liší.[10] Ryby jsou kromě savců jedinou skupinou s IgD geny.
U obojživelníků se protilátková odpověď studovala u rodu Xenopus. Nalezeny byly izotypy IgM, IgX a IgY. Všechny izotypy jsou tvořené čtyřmi imunoglobulinovými doménami. IgM obojživelníků je jako všechny obratlovčí IgM analogické k lidskému IgM. Dokáže tvořit pentamery s J-řetězcem.[10] IgX plní funkci mukózního izotypu.[9] IgY je analogické k lidskému IgG a částečně IgE, a je podobné předpokládanému společnému předkovi IgG a IgE. Obojživelníci jsou první skupinou obratlovců, u kterých se vyskytuje izotypový přesmyk.[9][10]
O izotypech u plazů se mnoho neví, u kajmanů a želv byly nalezeny IgM a IgY.[10]
Ptáci mají tři izotypy: IgM, IgY a IgA, z nichž každý může být na základě odlišného sestřihu mRNA transmembránový i sekretovaný. Hlavním sérovým izotypem je IgY, které plní stejné funkce, jako lidské IgG a IgE. Ptačí IgY se nejspíš vyvinulo ze stejného prekurzoru, jako savčí IgG a IgE. Ptačí IgA je homologní s lidským IgA, plní stejnou funkci, dokonce je schopné vázat lidskou sekretorickou komponentu.[10]
Oddělené IgG a IgE lze najít až u savců, včetně těch nejbazálnějších skupin. Kromě nich mají všichni savci IgM a IgA izotypy. IgD izotyp nebyl nalezen u všech skupin savců. Zajímavý izotyp mají velbloudiovití. Skládá se jen ze dvou těžkých řetězců, podobně jako IgNAR paryb.[10]
Myš
Jako významný modelový organizmus má myš výsadní postavení i ve studiu izotypů. Myš má stejné IgM, IgD, IgG, IgA a IgE izotypy jako člověk. Na rozdíl od člověka má pouze jeden subtyp IgA a byť má čtyři IgG subtypy, neodpovídají těm lidským ani funkčně, ani evolučně, jelikož společný předek myší a lidí měl jen jeden IgG subtyp a k jejich diverzifikaci došlo až po oddělení obou skupin.
Odkazy
Reference
- MURPHY, KENNETH (KENNETH M.),. Janeway's immunobiology. Ninth edition. vyd. New York, NY, USA: [s.n.] xx, 904 pages s. ISBN 9780815345053, ISBN 0815345054. OCLC 933586700
- BENGTÉN, E.; WILSON, M.; MILLER, N. Immunoglobulin Isotypes: Structure, Function, and Genetics. Příprava vydání Louis Du Pasquier, Gary W. Litman. Svazek 248. Berlin, Heidelberg: Springer Berlin Heidelberg Dostupné online. ISBN 9783642640780, ISBN 9783642596742. DOI 10.1007/978-3-642-59674-2_9. S. 189–219. DOI: 10.1007/978-3-642-59674-2_9.
- WOOF, Jenny M.; MESTECKY, Jiri. Mucosal immunoglobulins. Immunological Reviews. 2005-8, roč. 206, čís. 1, s. 64–82. Dostupné online [cit. 2019-06-22]. ISSN 0105-2896. DOI 10.1111/j.0105-2896.2005.00290.x. (anglicky)
- FENTON, J. A. L.; PRATT, G.; RAWSTRON, A. C. Isotype class switching and the pathogenenesis of multiple myeloma. Hematological Oncology. 2002-6, roč. 20, čís. 2, s. 75–85. Dostupné online [cit. 2019-06-22]. ISSN 0278-0232. DOI 10.1002/hon.688. (anglicky)
- XU, Zhenming; ZAN, Hong; PONE, Egest J. Immunoglobulin class-switch DNA recombination: induction, targeting and beyond. Nature Reviews Immunology. 2012-7, roč. 12, čís. 7, s. 517–531. Dostupné online [cit. 2019-06-22]. ISSN 1474-1733. DOI 10.1038/nri3216. (anglicky)
- SCHROEDER, Harry W.; CAVACINI, Lisa. Structure and function of immunoglobulins. Journal of Allergy and Clinical Immunology. 2010-2, roč. 125, čís. 2, s. S41–S52. Dostupné online [cit. 2019-06-22]. DOI 10.1016/j.jaci.2009.09.046. (anglicky)
- AALBERSE, R. C.; STAPEL, S. O.; SCHUURMAN, J. Immunoglobulin G4: an odd antibody. Clinical & Experimental Allergy. 2009-4, roč. 39, čís. 4, s. 469–477. Dostupné online [cit. 2019-06-22]. DOI 10.1111/j.1365-2222.2009.03207.x. (anglicky)
- NIRULA, Ajay; GLASER, Scott M; KALLED, Susan L. What is IgG4? A review of the biology of a unique immunoglobulin subtype:. Current Opinion in Rheumatology. 2011-1, roč. 23, čís. 1, s. 119–124. Dostupné online [cit. 2019-06-22]. ISSN 1040-8711. DOI 10.1097/BOR.0b013e3283412fd4. (anglicky)
- FLAJNIK, Martin F. Comparative analyses of immunoglobulin genes: surprises and portents. Nature Reviews Immunology. 2002-9, roč. 2, čís. 9, s. 688–698. Dostupné online [cit. 2019-06-23]. ISSN 1474-1733. DOI 10.1038/nri889. (anglicky)
- STAVNEZER, Janet; AMEMIYA, Chris T. Evolution of isotype switching. Seminars in Immunology. 2004-8, roč. 16, čís. 4, s. 257–275. Dostupné online [cit. 2019-06-23]. DOI 10.1016/j.smim.2004.08.005. (anglicky)