Komplement (biologie)
Komplement (komplementový soubor, zkratka C) je soubor asi 40 sérových a membránových glykoproteinů, které slouží jako humorální složka nespecifické imunity (spolu s interferony a dalšími plazmatickými proteiny).[1][2]

Úvod
Nejdůležitějšími proteiny komplementu jsou sérové proteiny C1–C9, které jsou syntetizovány hepatocyty a makrofágy. Podstatou aktivace jednotlivých složek komplementu je přeměna první neaktivní složky C1 na aktivní proteolytický enzym, který rozštěpí molekulu další složky na dva fragmenty (a a b), z nichž jeden má proteolytickou aktivitu (fragment b) tj. rozštěpí následující složku, a druhý (fragment a) má jinou biologickou aktivitu. Ústřední složkou je glykoprotein C3, jehož fragment C3b se kovalentně tj. pevně váže na povrch mikroorganismu. Meziprodukty této kaskádovité reakce mají různorodé biologické funkce (opsonizace, chemotaxe). Terminální produkt komplementové kaskády, komplex proteinů C5b, C6, C7, C8 a C9 (označovaný jako MAC: membrane attack complex) atakuje membrány vstupujícího mikroorganismu a působí jejich lýzi, a tedy zánik.[3]
Komplementový systém může být aktivován třemi způsoby: klasická cesta, alternativní cesta a lektinová cesta. Tyto dráhy se od sebe liší způsobem aktivace klíčové komponenty C3[3].
Komponenta C3
Protein C3 obsahuje thioesterovou vazbu mezi molekulou cysteinu a γ-karboxylem aminokyselinového zbytku kyseliny glutamové. Tato vazba je štěpena buď samovolně (pomocí molekul vody), nebo je aktivována reaktivními skupina jako jsou např. sacharidové zbytky nacházející se na povrchu biologických membrán. V prvním případě se jedná o cestu alternativní, ve druhém o cestu klasickou příp. lektinovou[2][3].
Názvosloví složek komplementu
- klasická dráha: jednotlivé proteiny jsou značeny číselně s předponou C, C1-C9 se označují jako komponenty
- alternativní dráha: kromě proteinů C1-C9 zde vystupují tzv. faktory, které jsou značeny alfabeticky B, D a properdin
- lektinová dráha: složky lektinové cesty jsou označovány jako tzv. kollektiny[4]
Hlavní funkce komplementu
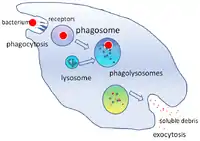
- Stimulace chemotaxe:komponenty C3 a C5 po proteolytickém štěpení (malé fragmenty a)přitahují fagocytující buňky do místa napadení mikroorganismem (zánětu).
- Zprostředkování opsonizace: fagocytující buňky mají na svém povrchu receptory pro složky komplementu
- Odstranění imunokomplexů: fagocytóza[2]
Historie
Komplement byl objeven koncem 19. století, kdy představoval určitou část krevního séra, které se muselo přidat k suspenzi bakterií spolu se specifickou protilátkou, aby došlo k usmrcení a lýzi oněch bakterií. Původním objevitelem byl Jules Bordet, belgický imunolog, jež roku 1896 nazval uvedenou část séra alexin. Za tento objev získal roku 1919 Nobelovu cenu[2].
Název komplement pochází z pozdější doby. Jeho autorem je německý chemik Paul Ehrlich. Pojem komplement vyjadřuje fakt, že komplementuje schopnost protilátky lyzovat bakterie. Samotná protilátka tuto schopnost nemá.[2]
Aktivace
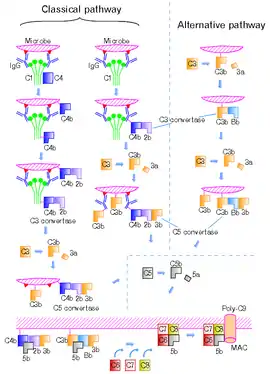
Komplement může být aktivován třemi cestami[4]:
- klasickou
- alternativní
- lektinovou
Klasická cesta aktivace komplementu
Tato cesta aktivace začíná na povrchu buněk (např. bakteriálních), na který jsou navázány protilátky. Na protilátku se váže glykoprotein C1, jež díky této vazbě změní svou konformaci, a tak nabude proteolytické aktivity. Následně C1 štěpí proteiny C4 a C2. Fragmenty C4b a C2a se naváží na povrch mikroorganismu a vytvoří tzv. klasickou C3-konvertázu (komplex C4bC2a), tj. enzym štěpící protein C3 na fragmenty C3a a C3b. Fragmenty C3a působí chemotakticky na fagocyty a C3b se zachycuje na povrchu tohoto enzymového komplexu a slouží jakou opsoniny. Posléze se vytváří další enzym tzv. klasická C5-konvertáza (C4bC3bC2a), jež štěpí protein C5 na C5a a C5b. Vznikem C5b začíná terminální tj. lytická fáze komplementové kaskády.
Klasická cesta aktivace komplementu může být zahájena kromě protilátek i C-reaktivním proteinem či sérovým amyloidem P. Tyto sérové proteiny se váží na některé mikroorganismy a poté jsou schopny se vázat a následně aktivovat protein C1[2][3].
Alternativní cesta aktivace komplementu
Alternativní cesta aktivace komplementu je ryze nespecifickou částí imunitního systému. Složka komplementu C3 se s určitou pravděpodobností samovolně štěpí na fragmenty C3a a C3b. C3b se kovalentně váže na povrch bakteriálních buněk a tím zahajuje kaskádu dalších reakcí. K C3b se naváže sérový protein tzv. faktor B, jež je proteolyticky štěpen na fragmenty Ba a Bb. Vzniklý komplex C3bBb je stabilizován dalším faktorem (properdin) a funguje jako tzv. alternativní C3-konvertáza. Některé její molekuly vzájemně reagují za vzniku složitějších komplexů tzv. C5-konvertázy (C3bBbC3b), jež štěpí protein C5. Fragment C5b zahajuje lytickou fázi komplementové kaskády[2][3].
Lektinová cesta aktivace komplementu

Tato cesta je obdobou klasické cesty aktivace komplementu s tím rozdílem, že jejím aktivátorem není protilátka, ale sérový lektin (lektin vážící manosu-MBL;mannose binding lectin). Ten se přímo váže na sacharidové zbytky na povrchu mikroorganismů a jelikož je strukturně podobný proteinu C1, tak také štěpí proteiny C4 a C2[2][3].
Lytická fáze komplementu

Fragment C5b, jež vznikl štěpením proteinu C5 C5-konvertázou, tvoří komplex s dalšími složkami komplementu-C6, C7, C8 a několika molekulami C9. Vzniklý komplex C5b678(9)n tzv. MAC (membrane attack complex) se zanoří do lipidové membrány mikrobiální buňky a vytvoří tak póry, kterými do napadené buňky vnikají molekuly vody. Dochází k nabobtnání buňky a následně k jejímu prasknutí a lýzi[1][2][3][4].
Odkazy
Reference
- Murray R.K., Granner D.K.:Harperova biochemie LANGE medical book, Connecticut, 1993, ISBN 80-85787-38-5
- Ferenčík M.,Rovenský J., Shoenfeld Y., Matha V.: Imunitní systém Avicenum, Praha, 2005, ISBN 80-247-1196-6
- Hořejší V., Bartůňková J.: Základy imunologie Triton, Praha, 2009, ISBN 978-80-7387-280-9
- Albrecht T., Almond J., Alfa M., Alton G.: Medical Microbiology The University of Texas Medical Branch, Galveston, 1996, ISBN 0-9631172-1-1
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu komplement na Wikimedia Commons
Obrázky, zvuky či videa k tématu komplement na Wikimedia Commons - Virology blog (anglicky)
- aktivace komplementu (animace, anglicky)
- The complement system (anglicky)
- Medical Microbiology (anglicky)