Ethyl-formiát
Ethyl-formiát neboli ethylester kyseliny mravenčí, systematický název ethyl-methanoát, dříve zvaný mravenčan ethylnatý je ester ethanolu a kyseliny mravenčí (methanové). Má charakteristickou rumovou vůni (je složkou tzv. tuzemského rumu[2] a je velmi minoritně zastoupen i mezi estery obsaženými v pravém rumu[3]) a je částečně odpovědný za chuť a vůni malin.[4]
| Ethyl-formiát | |
|---|---|
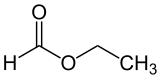
Vzorec | |
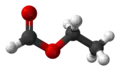
3D vzorec | |
| Obecné | |
| Systematický název | ethyl-methanoát, ethylester kyseliny methanové |
| Sumární vzorec | C3H6O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 109-94-4 |
| Číslo RTECS | VZ4725000 |
| Vlastnosti | |
| Molární hmotnost | 74,08 g/mol |
| Teplota tání | −80 °C, 193 K |
| Teplota varu | 54 °C, 327 K |
| Hustota | 0,917 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 R22 R36/38 |
| S-věty | Žádná rizika |
| NFPA 704 |  3
2
0
|
| Teplota vzplanutí | −20 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vlastnosti
Za běžných podmínek se jedná o bezbarvou kapalinu (teplota varu 54 °C), těkavou a extrémně hořlavou. Páry jsou výrazně těžší než vzduch a jejich směs se vzduchem je výbušná. S vodou se ethyl-formiát mísí jen částečně.[5]
Bezpečnost
Ethyl-formiát je v USA všeobecně považován za bezpečný.[6] Podle OSHA může dráždit oči, kůži, sliznice a dýchací systém člověka a jiných živočichů. Působí také tlumivě na centrální nervovou soustavu.[7] V průmyslu se používá jako rozpouštědlo nitrocelulózy, acetátu celulózy, olejů a jiných maziv. Lze ho používat namísto acetonu. K expozici může docházet v těchto situacích:[7]
- při nanášení nátěrových hmot stříkáním, natíráním nebo máčením
- při výrobě bezpečnostního skla
- při fumigaci tabáku, obilí a sušeného ovoce (jako alternativa k methylbromidu[6])
OSHA specifikuje povolený expoziční limit (PEL, vážený průměr za dobu 8 hodin) 100 ppm (300 mg/m³).
Limit v potravinách v USA: 0,0015%.
Výskyt ve vesmíru
Astronomové jej nalezli v prašných oblacích v oblasti Mléčné dráhy nazvané Sagittarius B2. Vědci z Planckova institutu pro radioastronomii v Bonnu použili k analýze spektra vlnění vyzařovaného z horkých oblastí blízko nové hvězdy třicetimetrový radioteleskop IRAM ve Španělsku. Ve změřených spektrech bylo identifikováno přibližně 50 různých sloučenin.[4]
Reference
V tomto článku byl použit překlad textu z článku Ethyl formate na anglické Wikipedii.
- Ethyl formate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- EFSA PANEL ON FOOD CONTACT MATERIALS, Enzymes, Flavourings and Processing Aids (CEF); SILANO, Vittorio; BOLOGNESI, Claudia. Scientific Opinion of Flavouring Group Evaluation 500 (FGE.500): rum ether. EFSA Journal. 2017-08-01, roč. 15, čís. 8. Dostupné online [cit. 2017-09-23]. ISSN 1831-4732. DOI 10.2903/j.efsa.2017.4897. (anglicky)
- LIEBICH, H. M.; KOENIG, W. A.; BAYER, E. Analysis of the Flavor of Rum by Gas-Liquid Chromatography and Mass Spectrometry. Journal of Chromatographic Science. 1970, s. 527–533. ISSN 0021-9665. DOI 10.1093/chromsci/8.9.527. (anglicky)
- SAMPLE, Ian. Galaxy's centre tastes of raspberries and smells of rum, say astronomers. The Guardian. 21 April 2009. Dostupné online [cit. 2009-04-21].
- Safety data for ethyl formate
- Alternative fumigants: Ethyl Formate [online]. University of California [cit. 2009-04-25]. Dostupné v archivu pořízeném dne 2009-05-30.
- Occupational Safety and Health Guideline for Ethyl Formate [online]. OSHA [cit. 2009-04-25]. Dostupné v archivu pořízeném dne 2009-04-14.
Externí odkazy
 Obrázky, zvuky či videa k tématu ethyl-formiát na Wikimedia Commons
Obrázky, zvuky či videa k tématu ethyl-formiát na Wikimedia Commons

