Fluorid cesný
Fluorid cesný je anorganická sloučenina, (halogenid) se vzorcem CsF. Krystaluje ve formě nejtěsnější krychlové (kubické) mřížky (jako NaCl). Používá se v organické syntéze jako zdroj fluoridového aniontu. Cesium je prvek s nejnižší elektronegativitou ze všech neradioaktivních prvků a fluor naopak vykazuje nejvyšší elektronegativitu ze všech prvků celkově.
| Fluorid cesný | |
|---|---|

Krystal CsF | |

Práškový CsF | |
| Obecné | |
| Systematický název | Fluorid cesný |
| Anglický název | Caesium fluoride Caesium(I) fluoride |
| Německý název | Caesiumfluodid |
| Sumární vzorec | CsF |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 13400-13-0 |
| Vlastnosti | |
| Molární hmotnost | 151,90 g/mol |
| Teplota tání | 682 °C |
| Teplota varu | 1 251 °C |
| Hustota | 4,115 g/cm3 |
| Rozpustnost ve vodě | 367 g/100 ml (18 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vznícení | Nehořlavý |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Příprava
Fluorid cesný se připravuje neutralizační reakcí hydroxidu cesného s kyselinou fluorovodíkovou:
- CsOH + HF → CsF + H2O
Další možností je reakce uhličitanu cesného s kyselinou fluorovodíkovou a následnou rekrystalizací produktuː
- Cs2CO3 + 2HF → 2CsF + H2O + CO2
Lze také požít přímé reakce elementárního cesia s plynným fluorem[2], ale tato cesta je nepraktická vzhledem k vysoké reaktivitě obou složek a tím k obtížné manipulaci s nimi během syntézy i zaručení bezpečnosti vzhledem k bouřlivé reakci obou prvků:
- 2Cs (s) + F2 (g) → 2CsF (s)
Využití
- Krystaly CsF jsou propustné pro infračervené záření a používají se proto pro výrobu okének a měrných cel v infračervené spektroskopii.
- Díky prakticky kompletní disociaci obou iontů v roztocích se CsF používá v organické syntéze jako zdroj fluoridového aniontu.
- Stejně jako jiné rozpustné fluoridy je CsF mírně bazický, protože HF je slabá kyselina. Nízká nukleofilita fluoridu znamená, že může být užitečnou bází v organické syntéze, poskytuje například vyšší výtěžky v Knoevenagelově kondenzaci než KF nebo NaCl.[3]
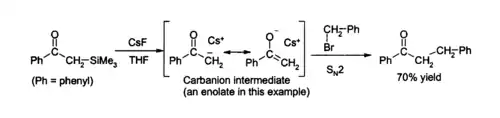
- Díky velmi silné chemické vazbě Si–F je fluoridový ion používán k desilanizační reakci, při které se z organokřemíkových sloučenin odstraní skupina obsahující křemík. Roztok fluoridu cesného v dimethylformanidu zde slouží jako výborný zdroj bezvodého fluoridového iontu.[4]
Podobné sloučeniny
Reference
- Cesium fluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Reacting Fluorine with Caesium. Youtube
- Fiorenza, M; MORDINI, A; PAPALEO, S; PASTORELLI, S; RICCI, A. Fluoride ion induced reactions of organosilanes: the preparation of mono and dicarbonyl compounds from β-ketosilanes. Tetrahedron Letters. 1985, s. 787–788. DOI 10.1016/S0040-4039(00)89137-6. (anglicky)
- SMITH, ADAM P.; LAMBA, JAYDEEP J. S. AND FRASER, CASSANDRA L. Efficient Synthesis of Halomethyl-2,2'-bipyridines: 4,4'-Bis(chloromethyl)-2,2'-bipyridine. Org. Synth.. 2002, s. 82. Dostupné online. (anglicky); Coll. Vol.. S. 107. (anglicky)