Enoláty
Enoláty jsou organické anionty vzniklé deprotonací karbonylových sloučenin. Málokdy je lze izolovat. Většinou se využívají jako reaktanty v organické syntéze.[1][2][3][4]
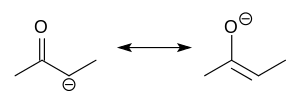
Struktura

Enolátové anionty jsou elektronově podobné allylovým aniontům. Záporný náboj je delokalizován na atomu kyslíku a dvou atomech uhlíku a sloučenina se tak částečně chová jako alkoxid a částečně jako karboanion.[5]
Přestože jsou často zobrazovány jako jednoduché soli, tak mají enoláty složité struktury, jež mnohdy vytváří shluky.[6]
Příprava
Enoláty lze připravit deprotonací enolizovatelných ketonů, aldehydů a esterů.[8][9]
Za přítomnosti silných zásad probíhá deprotonace kvantitativně. Nejčastěji se enoláty získávají reakcemi diisopropylamidu lithného (LDA).[10]
Často se enoláty, podobně jako při Claisenových kondenzacích, Mannichových reakcích a aldolových kondenzacích, získávají v nízkých koncentracích s využitím alkoxidů. Za takových podmínek se vyskytují v nízkých koncentracích, i přesto však reagují s elektrofily. Vlastnosti enolátů závisí na mnoha faktorech, největší vliv mají vlastnosti rozpouštědla, přidané látky (například diaminy) a protikationty (což mohou být mimo jiné Li+ nebo Na+). U nesymetrických ketonů byly vytvořeny metody umožňující řídit regiochemii deprotonace.[11]

Deprotonaci karbonových kyselin lze provést s kinetickým i termodynamickým řízením. Například fenylaceton může po deprotonaci vytvořit dva různé enoláty. LDA deprotonuje methylovou skupinu, přičemž docházíá ke kinetické deprotonaci. K zajištění tvorby kinetického produktu se přidává mírný přebytek (1,1 ekvivalentu) diisopropylamidu lithného a keton se přidá k zásadě při −78 °C. Protože se keton přemění na enolát rychle a kvantitativně a zásada se ve směsi nachází v přebytku, tak keton nemůže poskytovat protony katalyzující tvorbu termodynamického produktu. Slabší zásada, jako je alkoxid, která substrát deprotonuje vratně, vytvoří termodynamicky stabilnější benzylový enolát.
Enoláty lze zachytit s využitím acylace a silylace na kyslíku. Silylenolethery jsou častými reaktanty v organické syntéze, používají se například v Mukaijamových aldolových adicích:[13]
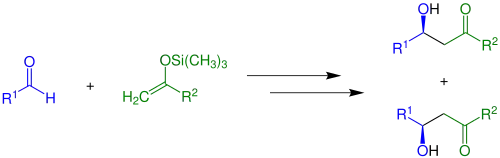
Reakce
Protože jde o silné nukleofily, tak enoláty snadno reagují s mnoha různými elektrofily. Obvyklými elektrofily zde jsou alkylhalogenidy, aldehydy, ketony a Michaelovy akceptory. Tyto reakce vytvářejí nové vazby C-C a často i nová stereocentra. Stereoselektivitu mohou ovlivnit látky přidané do reakční směsi.[14]
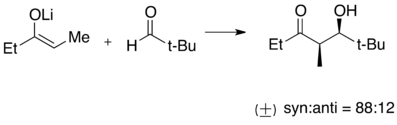 Příklad aldolové reakce lithného enolátu
Příklad aldolové reakce lithného enolátu
Azaenoláty
Azaenoláty (nazývané také jako iminové anionty, enamidy, metalované Schiffovy zásady nebo metaloenaminy) jsou dusíkaté analogy enolátů.[15]
Dají se připravit reakcemi iminů se silnými zásadami, jako je například diisopropylamid lithný (LDA); jde o silné nukleofily.
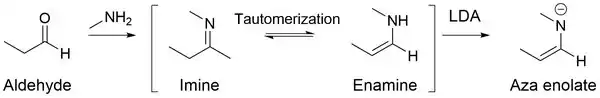
Hlavní výhodou azaenolátů je to, že u nich v zásaditých a neutrálních roztocích neprobíhají samokondenzace (například adolové reakce u aldehydů); místo toho dochází přednostně k alkylacím na alfa uhlících.[16] Tato vlastnost je způsobena přítomností dvojných vazeb mezi atomy uhlíku a dusíku v iminech, zatímco u aldehydů jde o dvojné vazby uhlík-kyslík. Větší elektronegativita kyslíku oproti dusíku způsobuje odtahování většího množství elektronové hustoty z karbonylového uhlíku, čímž vzniká větší částečný kladný náboj na uhlíku a elektrofilnější uhlík způsobuje u aldehydů snadnější nukleofilní adici na dvojnou vazbu.
Iminy mají méně elektronegativní dusík, který vytváří slabší kladný náboj na uhlíku. Přestože tak stále mohou reagovat s organolithnými sloučeninami, tak nereagují s ostatními nukleofily (jako jsou azaenoláty).[17]
Azaenoláty místo toho reagují podobně jako enoláty, za vzniku SN2 alkylovaných produktů.[16] Prostřednictvím konjugace s volným elektronovým párem dusíku se β uhlík stane nukleofilním, což předurčuje azaenoláty k alkylacím.[18] Mohou reagovat s řadou elektrofilů, jako jsou epoxidy a halogenalkany, za tvorby nových vazeb C-C na β uhlíku.[15]
Níže jsou zobrazeny dvě možné reakce azaenolátů:
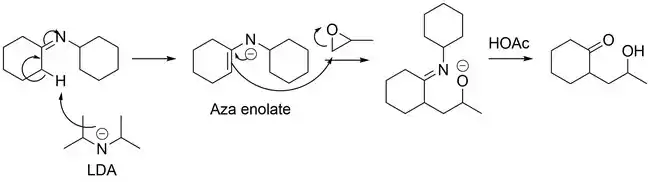
Protože mají epoxidy tříčlenný kruh, tak se u nich vyskytuje silné kruhové napětí. I přesto, že mají atomy uhlíku v kruhu jako nejstabilnější tetraedrickou molekulovou geometrii, s úhly 109,5° mezi jednotlivými atomy, tak u epoxidů mají tyto úhly hodnotu 60°, což napětí výrazně navyšuje. Nukleofilní azaenoláty tak snadno reagují s epoxidy a snižují jejich kruhové napětí.
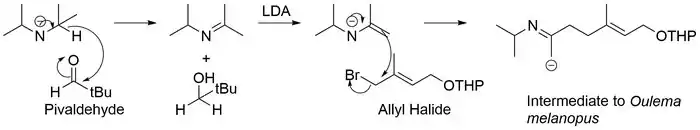
Mimo epoxidů mohou azaenoláty také reagovat s alkylhalogenidy nebo allylhalogenidy za tvorby nových vazeb sigma mezi atomy uhlíku. Tato reakce je důležitou součástí syntézy samčího feromonu u brouka kohoutka černohlavého (Oulema melanopus).[20]
Reference
V tomto článku byl použit překlad textu z článku Enolate na anglické Wikipedii.
- Daniel Stolz; Uli Kazmaier. PATai's Chemistry of Functional Group. [s.l.]: [s.n.], 2010. ISBN 9780470682531. DOI 10.1002/9780470682531.pat0423. Kapitola Metal Enolates as Synthons in Organic Chemistry.
- David J. Hart; Deok Chan Ha. The ester enolate-imine condensation route to .beta.-lactams. Chemical Reviews. 1989, s. 1447–1465. DOI 10.1021/cr00097a003.
- George Wu; Mingsheng Huang. Organolithium Reagents in Pharmaceutical Asymmetric Processes. Chemical Reviews. 2006, s. 2596–2616. DOI 10.1021/cr040694k. PMID 16836294.
- Claudio Curti; Lucia Battistini; Andrea Sartori; Franca Zanardi. New Developments of the Principle of Vinylogy as Applied to π-Extended Enolate-Type Donor Systems. Chemical Reviews. 2020, s. 2448–2612. DOI 10.1021/acs.chemrev.9b00481. PMID 32040305.
- Šablona:GoldBookRef
- Hans J. Reich. Role of Organolithium Aggregates and Mixed Aggregates in Organolithium Mechanisms. Chemical Reviews. 2013, s. 7130–7178. DOI 10.1021/cr400187u. PMID 23941648.
- Michael A. Nichols; Christina M. Leposa; Allen D. Hunter; Matthias Zeller. Crystal Structures of Hexameric and Dimeric Complexes of Lithioisobutyrophenone. Journal of Chemical Crystallography. 2013, s. 825–829. DOI 10.1007/s10870-007-9255-0.
- Šablona:March6th
- Manfred Braun. Modern Enolate Chemistry: From Preparation to Applications in Asymmetric Synthesis. [s.l.]: Wiley‐VCH, 2015. ISBN 9783527671069. DOI 10.1002/9783527671069.
- Christine Wedler; Hans Schick. Synthesis of Β-lactones By Aldolization of Ketones with Phenyl Ester Enolates: 3,3-Dimethyl-1-oxaspiro[3.5]nonan-2-one. Organic Syntheses. 1998, s. 116. DOI 10.15227/orgsyn.075.0116.
- Martin Gall; Herbert O. House. The Formation and Alkylation of Specific Enolate Anions from an Unsymmetrical Ketone: 2-Benzyl-2-methylcyclohexanone and 2-Benzyl-6-methylcyclohexanone. Organic Syntheses. 1972, s. 39. DOI 10.15227/orgsyn.052.0039.
- Jianshe Kong; Tao Meng; Pauline Ting; Jesse Wong. Preparation of Ethyl 1-Benzyl-4-Fluoropiperidine-4-Carboxylate. Organic Syntheses. 2010, s. 137. DOI 10.15227/orgsyn.087.0137.
- Teruaki Mukaiyama; Shū Kobayashi. Organic Reactions. [s.l.]: [s.n.], 1994. ISBN 0471264180. DOI 10.1002/0471264180.or046.01. Kapitola Tin(II) Enolates in the Aldol, Michael, and Related Reactions, s. 1–103.
- Dieter Seebach. Structure and Reactivity of Lithium Enolates. From Pinacolone to SelectiveC-Alkylations of Peptides. Difficulties and Opportunities Afforded by Complex Structures. Angewandte Chemie International Edition in English. 1988, s. 1624–1654. DOI 10.1002/anie.198816241.
- O. Aslam. Development of catalytic aza enolate reactions [online]. University College London, 2012-09-28. Dostupné online.
- Jonathan Clayden. Organic chemistry. [s.l.]: Oxford University Press, 2012. ISBN 9780199270293. S. 465, 593–594.
- Philippa Cranwell. Enamines/aza-enolates – Mechanism Mordor [online]. [cit. 2021-09-02]. Dostupné v archivu pořízeném dne 2021-09-03.
- Francis A. Carey. Advanced organic chemistry. Part B, Reactions and synthesis. New York: Springer, 2007. ISBN 978-0-387-68350-8. S. 46–47.
- Paul F. Hudrlik; Chung-Nan Wan. Reactions of oxetane with imine salts derived from cyclohexanone. The Journal of Organic Chemistry. 1975, s. 2963–2965. DOI 10.1021/jo00908a027.
- Alice Chevalley; Jean-Pierre Férézou. One-pot formation of aza-enolates from secondary amines and condensation to esters and alkyl bromides. Tetrahedron. 2012, s. 5882–5889. DOI 10.1016/j.tet.2012.04.105.
%253DCMe2(Litmeda)_dimer_(VITLUG).png.webp)