Dehalogenace
Dehalogenace je označení pro chemické reakce, při kterých dochází k odštěpení halogenu z molekuly. Dělí se na dva druhy: redukční dehalogenaci a dehydrohalogenaci.
.png.webp)
Historie
V roce 1832 připravil Justus von Liebig první organohalogenid chlorací ethanolu a poté začaly být tyto látky podrobně zkoumány.[1] Organohalogenidy jsou často pesticidy, chladiva, reaktanty, rozpouštědla a polymery.[2] [3][4]
Rychlost dehalogenace
Fluor má ze všech halogenů nejelektronegativnější atomy a tak vytváří s atomy uhlíku nejpevnější vazby; disociační energie vazeb jsou takovéto: H3C-I (234 kJ/mol), H3C-Br (293 kJ/mol), H3C-Cl (351 kJ/mol), H3C-F (452 kJ/mol), reaktivita tak obecně roste v řadě F<< Cl < Br < I.[4] Rychlost dehalogenace také ovlivňují sterické faktory, takže primární alkylhalogenidy reagují rychleji než sekundární, které jsou zase reaktivnější než terciární.[4]
Rychlosti dehalogenačních reakcí také závisí na použitém katalyzátoru, obzvláště oxidačním čísle v něm obsaženého kovu, a na použitých redukčních činidlech.
Dehalogenace s použitím alkalických kovů a kovů alkalických zemin
Alkalické kovy a kovy alkalických zemin, například lithium, sodík, draslík, hořčík a vápník, jsou dobrými katalyzátory dehalogenací. V průběhu reakce fungují kovy jako redukční činidla, která štěpí vazby uhlík-halogen, halogen se poté stává odstupující skupinou. Na následujícím obrázku je znázorněna obecná dehalogenační reakce katalyzovaná takovým kovem:
Jako katalyzátory lze použít různé lithné naftalenidy, které je možné použít k lithiaci různých halogenalkanů. Li-aren reaguje s vodou nebo deuteriem za vzniku dehalogenovaného produktu.[5][6][7] Hlavní nevýhodou lithných katalyzátorů je jejich obtížné oddělování z reakční směsi, protože naftalen se absorbuje na arenových substrátech. V polymerové chemii se k dehalogenacím používá kovový sodík.[8][9]
Odstraněním atomu halogenu z halogenarenu za přítomnosti Grignardova činidla a vody dochází k procesu známému jako Grignardova degradace; jde o dvoustupňový proces, který začíná tvorbou alkyl/arylmagnesiumhalogenidu a pokračuje adicí zdroje protonů za tvorby dehalogenované sloučeniny. Byla popsána dehalogenace benzylhalogenidů při teplotě 600 °C pomocí atomárního hořčíku, přičemž se vytváří tolueny a bibenzyly;[10] a také dehalogenace organohalogenidů vakuovou pyrolýzou.[11]
Dehalogenace s použitím komplexů přechodných kovů
Jsou známy různé metody dehalogenace využívající jako katalyzátory komplexy přechodných kovů.[12] Sloučeniny vanadu v nízkých oxidačních číslech zprostředkovávají dehalogenace jednoelektronovou redukcí. Účinnost přitom záleží na redoxním potenciálu komplexu i radikálofilu.[13] Jako redukční činidlo k dehalogenaci řady alkylhalogenidových i arylhalogenidových substrátů může být použit rovněž dihydrid lithnochromný.[14]
_dihydride.png.webp)
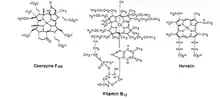
Z ostatních kovů bylo v souvislosti s dehalogenačními reakcemi nejpodrobněji prozkoumáno železo. G. Cahiez popsal redukci bromalkanů pomocí manganatých halogenidů za přítomnosti Fe(acac)3.[15] Byla též popsána dehydrobromace 1,1,-dibrom-1-alkenů za přítomnosti Fe a Co.[16] Vitamin B12 a koenzym F430 mohou dechlorovat tetrachlorethen na ethen, zatímco hematin lze použít k dechloraci tetrachlorethenu na vinylchlorid.[17]
Komplexy fluoridu železnatého byly použity k dehydrofluoraci fluorovaných uhlovodíků.[18]
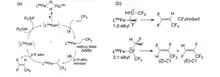
Také byly vyvinuty dvoufázové systémy pro dehalogenaci trichlorethenů. Podle kinetického modelu v jedné fázi probíhá samotná reakce, zatímco mezi fázemi dochází k přesunu hmoty.[19]
Je známo několik způsobů dehalogenace využívajících ke katalýze další kovy, jako jsou kobalt, nikl, palladium, a také křemík nebo germanium.[20][2][21]
Reference
V tomto článku byl použit překlad textu z článku Dehalogenation na anglické Wikipedii.
- Klein, U. Experiments, models, paper tools: Cultures of organic chemistry in the nineteenth century, Stanford university press: California, 2003, 191-193
- J. Moon; S. Lee. Palladium catalyzed-dehalogenation of aryl chlorides and bromides using phosphite ligands. Journal of Organometallic Chemistry. 2009, s. 473–477.
- Ware, G.; Gunther, F. Reviews of environmental contamination and toxicology, Springer-Verlag: New York, 1998, 155, 1-67.
- Barry M. Trost; Ian Fleming. Comprehensive organic synthesis – selectivity, strategy and efficiency in modern organic chemistry. [s.l.]: Elsevier, 1991. ISBN 0080359299. S. 793–809.
- Ramón, D.; Yus, M. Masked lithium bishomoenolates: Useful intermediates in organic synthesis, J. Org. Chem. 1991, 56, 3825-3831.
- Guijarro, A.; Ramón, D.; Yus, M. Naphthalene-catalysed lithiation of functionalized chloroarenes: regioselective preparation and reactivity of functionalized lithioarenes, Tetrahedron, 1993, 49, 469-482
- Yus, M.; Ramón, D. Arene-catalysed lithiation reactions with lithium at low temperature, Chem. Comm. 1991, 398-400
- Hawari, J. Regioselectivity of dechlorination: reductive dechlorination of polychlorobiphenyls by polymethylhydrosiloxane-alkali metal. J. Organomet. Chem. 1992, 437, 91-98.
- Mackenzie, K.; Kopinke, F.-D. Debromination of duroplastic flame-retarded polymers. Chemosphere, 1996, 33, 2423-2428
- Tarakanova, A.; Anisimov, A.; Egorov, A. Low-temperature dehalogenation of benzyl halides with atomic magnesium in the 3P state. Russian Chemical Bulletin, 1999, 48, 147-151
- Aitken, R.; Hodgson, P; Oyewale, A.’ Morrison, J. Dehalogenation of organic halides by flash vacuum pyrolysis over magnesium: a versatile synthetic method. Chem. Commun. 1997, 1163-1164
- Grushin, V.; Alper, H. Activation of otherwise unreactive C-Cl bonds. Top. Organomet. Chem. 1999, 3, 193-226.
- Hirao, T.; Hirano, K.; Hasegawa, T.; Oshiro, Y.; Ikeda, I. A novel system consisting of low-valent vanadium and diethyl phosphonate or triethyl phosphite for the highly stereoselective reduction of gem-dibromocyclopropanes. J. Org. Chem. 1993, 58, 6529-6530
- Eisch, J.; Alila, J. Lithium chromium(I) dihydride: a novel reagent for the versatile reductive metathesis, reductive cyclization, oligomerization, or polymerization of diverse organic substrates. Organometallics, 2000, 19, 1211-1213
- Cahiez, G.; Benard, D.; Normant, J. Reduction des halogenures vinyliques et aryliques par les organomagnesiens en presence de manganese(II). J. organomet. Chem. 1976, 113, 107-113
- Fakhfakh, M.; Franck, X.; Hocquemiller, R.’ Figadere, B. Iron catalyzed hydrodebromination of 2-aryl-1,1-dibromo-1-alkenes. J. Organomet. Chem. 2001, 624, 131-135
- Gantzer, C.; Wackett, L. Reductive dichlorination catalyzed by bacterial transition-metal coenzymes. Environ. Sci. Technol. 1991, 25, 715-722
- Vela, J.; Smith, J; Yu, Y.; Ketterer, N.; Flaschenriem, C.; Lachicotte, R.; Holland, P. Synthesis and reactivity of low-coordinate iron (II) fluoride complexes and their use in the catalytic hydrodefluorination of fluorocarbons. J. Am. Chem. Soc. 2005, 127, 7857-7870
- Gotpagar, J.; Grulke, E.; Bhattacharyya, D.; Reductive dehalogenation of trichloroethylene: kinetic models and experimental verification. J. Hazardous mat. 1998, 62, 3, 243-264
- Hetflejš, J.; Czakkoova, M.; Rericha, R.; Vcelak, J. Catalyzed dehalogenation of delor 103 by sodium hydridoaluminate. Chemosphere 2001, 44, 1521.
- Kagoshima, H.; Hashimoto, Y.; Oguro, D.; Kutsuna, T.; Saigo, K. Trophenylphosphine/germanium (IV) chloride combination: A new agent for the reduction of α-bromo carboxylic acid derivatives. Tetrahedron, 1998, 39, 1203-1206