Bis(trimethylsilyl)amin
Bis(trimethylsilyl)amin (jinak nazývaný hexamethyldisilazan nebo HMDS) je organokřemičitá sloučenina se vzorcem [(CH3)3Si]2NH. Jedná se o derivát amoniaku, u kterého jsou dva vodíkové atomy nahrazeny trimethylsilylovými skupinami. Délka vazby křemík-dusík (173,5 pm) a úhel vazby Si-N-Si (125,5°) jsou podobné jako u disilazanu (u kterého jsou místo methylových skupin atomy vodíku), což naznačuje jen nepatrný vliv sterických faktorů.[2]
| Bis(trimethylsilyl)amin | |
|---|---|
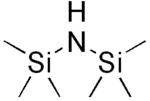
Strukturní vzorec | |
Model molekuly | |
| Obecné | |
| Systematický název | 1,1,1-trimethyl-N-(trimethylsilyl)silanamin |
| Ostatní názvy | [dimethyl-(trimethylsilylamino)silyl]methan, hexamethyldisilylazan |
| Funkční vzorec | [(CH3)3Si]2NH |
| Sumární vzorec | C6H19NSi2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 27495-70-1 |
| EC-no (EINECS/ELINCS/NLP) | 213-668-5 |
| PubChem | 13838 |
| ChEBI | 85068 |
| SMILES | C[Si](C)(C)N[Si](C)(C)C |
| InChI | 1S/C6H19NSi2/c1-8(2,3)7-9(4,5)6/h7H,1-6H3 |
| Číslo RTECS | JM9230000 |
| Vlastnosti | |
| Molární hmotnost | 161,39 g/mol |
| Teplota varu | 125 °C (398 K)[1] |
| Hustota | 0,7741 g/cm3[1] |
| Index lomu | 1,4090 (20 °C)[1] |
| Rozpustnost ve vodě | nerozpustný, reaguje[1] |
| Rozpustnost v polárních rozpouštědlech |
rozpustný v acetonu[1] |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v diethyletheru, benzenu a heptanu[1] |
| Tlak páry | 1,84 kPa[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H302 H311 H312 H314 H318 H332 H335 H412[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P261 P264 P270 P271 P280 P301+312 P301+330+331 P302+352 P303+361+353 P304+312 P304+340 P305+351+338 P310 P312 P321 P322 P330 P361 P363 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | 27 °C (300 K)[1] |
| Teplota vznícení | 325 °C (598 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Používá se jako reaktant a jako prekurzor zásad nacházejících využití v organické syntéze a organokovové chemii. HMDS má také využití jako molekulární prekurzor při chemické depozici z plynné fáze sloužící k tvorbě tenkých vrstev karbonitridů křemíku.
Příprava a deriváty
Bis(trimethylsilyl)amin se připravuje reakcí trimethylsilylchloridu s amoniakem:[3]
- 2 (CH3)3SiCl + 3 NH3 → [(CH3)3Si]2NH + 2 NH4Cl
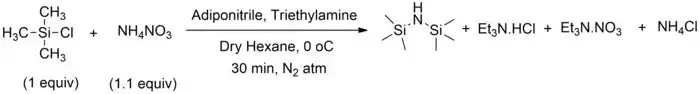
Lze také použít dusičnan amonný s triethylaminem.[4] Tímto způsobem se dá také získat HMDS obohacený o 15N.
Deprotonaci bis(trimethylsilyl)aminu se připravují bis(trimethylsilyl)amidy alkalických kovů, například bis(trimethylsilyl)amid lithný (LiHMDS) se připravuje pomocí n-butyllithia:
- [(CH3)3Si]2NH + BuLi → [(CH3)3Si]2NLi + BuH
LiHMDS a jeho deriváty bis(trimethylsilyl)amid draselný (KHMDS) a bis(trimethylsilyl)amid sodný (NaHMDS) se používají v organické chemii jako jako nenukleofilní zásady.
Použití
Jako reaktant
Hexamethyldisilazan se zapojuje do řady organických reakcí:
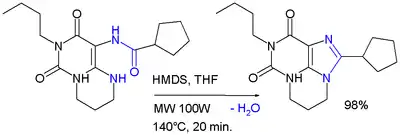
1) HMDS je reaktantem při kondenzačních reakcích heterocyklických sloučenin, například při mikrovlnné syntéze derivátu xanthinu:[5]
2) Trimethylsilylace alkoholů, thiolů, aminů a aminokyselin za účelem zavedení chránicích skupin nebo přípravy meziproduktů syntézy organokřemičitých sloučenin je účinným postupem, který nahradil používání trimethylsilylchloridu.[6]
Silylací kyseliny glutamové za přítomnosti nadbytku hexamethyldisilazanu a katalytického množství trimethylsilylchloridu v xylenu nebo acetonitrilu a následným zředěním methanolem nebo ethanolem vzniká kyselina pyroglutamová.

HMDS za přítomnosti jodu silyluje alkoholy.

3) HMDS lze použít na silylaci laboratorního skla, které se tak stane hydrofobním.
4) V plynové chromatografii lze HMDS použít k silylaci hydroxylových skupin organických sloučenin k zajištění vyšší těkavosti, což umožní touto metodou analyzovat sloučeniny, které jinak těkavé nejsou.
Ostatní použití
Ve fotolitografii se HMDS často používá ke zvyšování přilnavosti fotorezistů. Nejlepších výsledků se dosáhne depozicí HMDS z plynné fáze na zahřívané substráty.[7][8]
V elektronové mikroskopii může být HMDS použit jako náhrada vysoušení při kritickém bodu během přípravy vzorku.[9]
Při pyrolýze s plynovou chromatografií a hmotnostní spektrometrií se HMDS přidává k analytu, kde vytváří při pyrolýze silylované produkty, čímž se usnadňuje detekce sloučenin s polárními funkčními skupinami.[10]
Při plazmou obohacené chemické depozici z plynné fáze slouží jako molekulový prekurzor, přičemž nahrazuje vysoce hořlavé a žíravé plyny, jako SiH4, CH4 a NH3, protože jej lze snadno skladovat. HMDS se používá ve spojení s plazmou různých plynů, například argonu, helia a dusíku, k tvoření tenkých vrstev SiCN, které mají velmi dobré mechanické, optické a elektronické vlastnosti.[11]
Odkazy
Související články
- Hexamethyldisiloxan
- Bis(trimethylsilyl)amidy
Externí odkazy
 Obrázky, zvuky či videa k tématu Bis(trimethylsilyl)amin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bis(trimethylsilyl)amin na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Bis(trimethylsilyl)amine na anglické Wikipedii.
- Hexamethyldisilazane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- D. A. Armitage. Organosilicon - an overview. Comprehensive Organometallic Chemistry. 1982, s. 1–203. Dostupné online. DOI 10.1016/B978-008046518-0.00014-3.
- Robert C. Osthoff; Simon W. Kantor. Organosilazane Compounds. Inorganic Syntheses. 1957, s. 55–64. ISBN 978-0-470-13236-4. DOI 10.1002/9780470132364.ch16.
- S. V. Chernyak; YU. G. YATLUK; A. L. SUVOROV. A Simple Synthesis of Hexamethyldisilazane (Translated from Zhurnal obshcheĭ khimiĭ, Vol. 70. No. 8, 2000. p1401). Russian Journal of General Chemistry. 2000, s. 1313. (anglicky)
- J. C. Burbiel; J. Hockemeyer; C. E. Müller. Microwave-assisted ring closure reactions: Synthesis of 8-substituted xanthine derivatives and related pyrimido- and diazepinopurinediones. Beilstein Journal of Organic Chemistry. 2006, s. 20. ISBN 978-0-470-13236-4. DOI 10.1186/1860-5397-2-20. PMID 17067400.
- Benjamin A. Anderson; Vikas Sikervar. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. ISBN 0471936235. DOI 10.1002/047084289X.rh016. Kapitola Hexamethyldisilazane.
- Cornell NanoScale Science & Technology Facility. CNF - Photolithography Resist Processes and Capabilities [online]. [cit. 2008-01-29]. Dostupné v archivu pořízeném dne 2019-09-07.
- YES Prime Oven Stanford Nanofabrication Facility [online]. Stanford Nanofabrication Facility. Dostupné online.
- D. F. Bray; J. Bagu; P. Koegler. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microscopy Research and Technique. 1993, s. 489–495. DOI 10.1002/jemt.1070260603. PMID 8305726.
- Giuseppe Chiavari; Daniele Fabbri; Silvia Prati. Gas chromatographic–mass spectrometric analysis of products arising from pyrolysis of amino acids in the presence of hexamethyldisilazane. Journal of Chromatography A. 2001, s. 235–241. DOI 10.1016/S0021-9673(01)00936-0. PMID 11486868.
- P. Jedrzejowski; J. Cizek; A. Amassian; J. E. Klemberg-Sapieha. Mechanical and optical properties of hard SiCN coatings prepared by PECVD. Thin Solid Films. 2004, s. 201–207. DOI 10.1016/S0040-6090(03)01057-5. Bibcode 2004TSF...447..201J.