Acylace
Acylace (také se používá označení alkanoylace) je chemická reakce, při které dochází k připojení acylové skupiny na chemickou sloučeninu. Sloučenina sloužící jako zdroj acylové skupiny se nazývá acylační činidlo.
Protože vytvářejí s některými kovovými katalyzátory silné elektrofily, tak se jako acylační činidla často používají acylhalogenidy, například při Friedelově–Craftsově acylaci může být použit acetylchlorid (ethanoylchlorid), CH3COCl, jako zdroj acylu, a jako katalyzátor například chlorid hlinitý, AlCl3, k navázání acetylové skupiny na benzen:
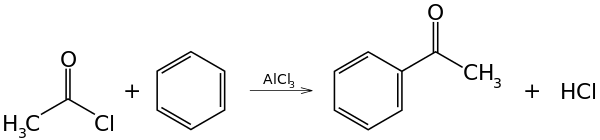
Tato reakce patří mezi elektrofilní aromatické substituce.
Kromě acylhalogenidů se také používají anhydridy karboxylových kyselin; v některých případech mohou podobnou reaktivitu mít také aktivní estery. Všechny tyto sloučeniny vytvářejí amidy a alkoholy, ze kterých lze nukleofilní acylovou substitucí získat estery.
Acylace mohou být použity k zabránění přesmykovým reakcím často se objevujícím při alkylacích. Po provedení acylace se vzniklý karbonyl odstraní Clemmensenovou redukcí nebo podobným procesem.[1]
Acylace v biochemii
Acylace bílkovin je druh posttranslační modifikace spočívající v navázání funkční skupiny přes acyly. Acylace bílkovin byla identifikována jako mechanismus ovlivňující biologickou signalizaci.[2]
Významným druhem této reakce je acylace mastnými kyselinami, kdy se na některou z aminokyselin (například myristoylace, palmitoylace nebo palmitoleoylace).[3]
Acylace bílkovin se účastní různé druhy mastných kyselin.[4]
Při palmitoleoylaci se kyselina palmitoolejová kovalentně navazuje na serinové nebo threoninové zbytky.[5][6]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Acylation na anglické Wikipedii.
- Peter Vollhardt; Neil Schore. Organic Chemistry: Structure and Function. New York: W.H. Freeman and Company, 2014. Dostupné online. ISBN 978-1-4641-2027-5. S. 714–715.
- D. A. Towler; J. I. Gordon; S. P. Adams; L. Glaser. The Biology and Enzymology of Eukaryotic Protein Acylation. Annual Review of Biochemistry. 1988, s. 69–97. DOI 10.1146/annurev.bi.57.070188.000441. PMID 3052287.
- M. D. Resh. Fatty acylation of proteins: New insights into membrane targeting of myristoylated and palmitoylated proteins. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1999, s. 1–16. DOI 10.1016/S0167-4889(99)00075-0. PMID 10446384.
- Fatemeh Mohammadzadeh; Vahid Hosseini; Amir Mehdizadeh; Christian Dani; Masoud Darabi. A method for the gross analysis of global protein acylation by gas–liquid chromatography. IUBMB Life. 2019, s. 340–346. ISSN 1521-6551. DOI 10.1002/iub.1975. PMID 30501005.
- Rami N. Hannoush. Synthetic protein lipidation. Current Opinion in Chemical Biology. 2015, s. 39–46. ISSN 1879-0402. DOI 10.1016/j.cbpa.2015.05.025. PMID 26080277.
- Francisco Pelegri; Michael Danilchik; Ann Sutherland. Vertebrate development : maternal to zygotic control. [s.l.]: [s.n.], 2016-12-13. ISBN 9783319460956.
- Vahid Hosseini; Christian Dani; Mohammad Hossein Geranmayeh; Fatemeh Mohammadzadeh; Saeed Nazari Soltan Ahmad; Masoud Darabi. Wnt lipidation: Roles in trafficking, modulation, and function. Journal of Cellular Physiology. 2018-10-20, s. 8040–8054. ISSN 1097-4652. DOI 10.1002/jcp.27570. PMID 30341908.
- Aaron H. Nile; Rami N. Hannoush. Fatty acylation of Wnt proteins. Nature Chemical Biology. 2016, s. 60–69. ISSN 1552-4469. DOI 10.1038/nchembio.2005. PMID 26784846.