Propán-1,2-diol
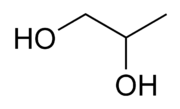
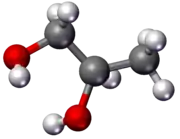
Propán-1,2-diol taktiež aj 1,2-propándiol a α-propylénglykol, okrem toho často označovaný aj iba propylénglykol, je jeden zo štyroch izomérov propylénglykolu (propándiolu). Je to bezfarebná hygroskopická väzká kvapalina, bez takmer akejkoľvek vône, s mierne sladkou chuťou. Z hľadiska štruktúry ide o dvojsýtny alkohol (diol) odvodený od propánu s hydroxylovými skupinami naviazanými na 1. a 2. atóme uhlíku. Pretože obsahuje asymetrický atóm uhlíka vyskytuje sa v dvoch enantioméroch. Bežne dostupný propylénglykol je racemát, pričom na výrobu iba jedného z enantiomérov sa používa hydratácia propylénoxidu. Je miešateľný s mnohými rozpúšťadlami, ako napríklad voda, acetón, etanol, chloroform, dietyléter... V potravinárstve sa označuje E číslom E 1520, vo farmakológii a v kozmetických výrobkoch E 490.
| Propán-1,2-diol | |||||||||||||||||||||||||
 Propán-1,2-diol | |||||||||||||||||||||||||
 Propán-1,2-diol | |||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||
| Sumárny vzorec | C3H8O2 | ||||||||||||||||||||||||
| Synonymá | propylénglykol, α-propylénglykol, propándiol, 1,2-propándiol, 1,2-dihydroxypropán, E 1520, E 490 | ||||||||||||||||||||||||
| Vzhľad | Bezfarebná väzká tekutina s mierne sladkou chuťou | ||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||
| Molárna hmotnosť | 76,095 g·mol−1 | ||||||||||||||||||||||||
| Teplota topenia | −59 °C (214 K) | ||||||||||||||||||||||||
| Teplota varu | 188,2 °C (461,3 K) | ||||||||||||||||||||||||
| Hustota | 1,036 g/cm3 | ||||||||||||||||||||||||
| Rozpustnosť | Miešateľný s vodou, etanolom, acetónom, dietyléterom a chloroformom | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||
| Číslo CAS | 57-55-6 | ||||||||||||||||||||||||
| EINECS číslo | 200-338-0 | ||||||||||||||||||||||||
| Číslo RTECS | TY6300000 | ||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||
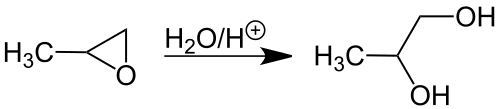
Výroba
Priemyselná
Priemyselne sa propylénglykol vyrába hydratáciou propylénoxidu. Existujú 2 spôsoby používané pri takejto výrobe. Buď bez katalyzátoru pri 200 – 220 °C, alebo s katalyzátorom pri 150 – 180 °C. Katalyzátorom môže v takomto prípade drobné množstvo kyseliny sírovej alebo zásady. Reakčná zmes pri takomto spôsobe výroby pozostáva 20 % z propylénglykolu, 1,5 % dipropylénglykolu a taktiež malého množstva polypropylénglykolu.
Využitie
Približne 45 % z vyrábaného propylénglykolu sa používa ako surovina na výrobu nenasýtených polyesterových živíc a na výrobu polymérov a oligomérov z ktorých sa potom vyrábajú polyuretánové polyméry.
Pridáva sa aj do akrylových farieb na báze vody, v ktorých spomaľuje ich schnutie a to vďaka tomu, že je menej prchavý ako voda čo znamená, že sa dlhšie odparuje a farba schne pomalšie. Okrem toho je spolu s glycerínom hlavnou zložkou náplní do elektronických cigariet (1 – 92 % obsahu).[1] Občas sa využíva aj v niektorých modeloch parných železníc a parníkov, kde je umiestnený vnútri, kde sa pomocou malého ohrevného telesa zohrieva a následne sa vyparuje von komínmi na modeli, čím vytvára dojem pary a dymu.
Pridáva sa aj do mnohých potravinových výrobkov, ako napríklad tekuté sladidlá, kávové výrobky, zmrzlina a rôzne šľahané mliečne produkty.[2][3] Používa sa aj ako rozpúšťadlo rôznych liekov, ako napríklad diazepam alebo lorazepam, ktoré sú nerozpustné vo vode.[4]
Podobne ako etylénglykol, propylénglykol dokáže v roztoku s vodou znížiť jej teplotu topenia a preto sa používa ako kvapalina na rozmrazovanie lietadiel.[5] Taktiež sa kvôli svojej nízkej toxicite namiesto etylénglykolu používa ako nemrznúca tekutina.
Podľa jedného výskumu sa dá podobne ako 95 % etanol použiť ako konzervačná látka na DNA mravcov. Výhoda oproti etanolu je, že propylénglykol nie je taký horľavý vyparuje sa pomalšie ako etanol a preto je vhodnejší pri preprave takýchto vzoriek DNA.
Toxikológia a bezpečnosť
Peroorálne podanie
Pri peroorálnom podaní má propylénglykol veľmi nízku toxicitu. V tele sa metabolizuje na kyselinu pyrohroznovú (ktorá taktiež vzniká ako súčasť normálneho metabolizmu glukózy), kyselinu octovú, kyselinu mliečnu a propionaldehyd (možná zdravotne škodlivá látka).[6][7] Podľa výskumov Dow Chemical Company je LD50 tejto látky pre potkany pri peroorálnom podaní 20 g/kg.[8]
Vážne zdravotné problémy nastávajú, keď propylénglykol dosiahne v tele koncentráciu 4 g/l krvi. Na dosiahnutie takejto koncentrácie by však bolo potrebné požiť veľmi veľké množstvá za krátku dobu. Do potravín sa propylénglykol pridáva najviac v množstvách 1 g/kg potraviny, takže otrava z propylénglykolu obsiahnutého v potravinách je takmer nemožná.
Jeho dlhodobá peroorálna toxicita je taktiež dosť nízka. Podľa istého výskumu vykonaného v roku 1972, pri ktorom bolo 12 potkanov kŕmených 2 roky s krmivom, ktoré obsahovalo 5 % propylénglykolu sa na nich neprejavili žiadne príznaky dlhodobej toxicity.[9]
Kontakt s pokožkou, očami a inhalácia
Propylénglykol nie je dráždivý pre pokožku a to ani pri dlhšom styku s ňou. Pre oči je neriedený propylénglykol dráždivý len málo, pričom môže vyvolať prechodný zápal spojiviek, ktorý prejde krátko po tom ako sa propylénglykol z oka vymyje. Vystavenie sa aerosólom propylénglykolu môže podráždiť horné dýchacie cesty. Preto sa neodporúča propylénglykol používať tam, kde je pravdepodobné, že dôjde k vystaveniu očí alebo k jeho vdychovaniu, ako napríklad stroje na dymové efekty, očné kvapky a pod.[10] Propylénglykol taktiež nespôsobuje senzibilizáciu a ani nie je karcinogén či genotoxín[11].
Vnútrožilové podanie
U mnohých ľudí ktorým boli podané liečivá, ktoré ako pomocnú zložku obsahovali propylénglykol sa prejavili rôzne zdravotné ťažkosti, najmä pri veľkých dávkach takýchto liekov. Takýmito zdravotnými problémami môžu byť napríklad pokles krvného tlaku, spomalený srdcový tep, abnormality na QRS a T segmente EKG, iné srdcové arytmie až zástava srdca a taktiež rozpad červených krviniek.[12]
12 – 42 % vnútrožilovo prijatého propylénglykolu sa z tela odstraňuje v moči v nezmenenej podobe a zvyšok sa premieňa na jeho glukuronid. Rýchlosť akou obličky dokážu z krvi propylénglykol odstrániť je nepriamo úmerná prijatej dávke[13], jedno z vysvetlení je, že toto je spôsobené miernymi sedatívnymi účinkami propylénglykolu.
V jednom prípade spôsobilo podanie glyceroltrinitrátu rozpustného v propylénglykolu staršiemu pacientovi prekyslenie tela a kómu.[14]
Referencie
- Electronic cigarettes: Help or hazard? Harvarská zdravotná škola (po anglicky)
- Quackmail: Why You Shouldn't Fall For The Internet's Newest Fool, The Food Babe., Forbes (po anglicky)
- JACKSON, G.; ROBERTS, R. T.; WAINWRIGHT, T.. Mechanism of Beer Foam Stabilization by Propylene Glycol Alginate. Journal of the Institute of Brewing, 1980, roč. 86, čís. 1, s. 34–37. Dostupné online [cit. 2019-03-09]. ISSN 2050-0416. DOI: 10.1002/j.2050-0416.1980.tb03953.x. (po anglicky)
- Propylene glycol INCHEM (po anglicky)
- AIRCRAFT DEICERS (po anglicky)
- MILLER, O. Neal; BAZZANO, Gaetano. Propanediol Metabolism and Its Relation to Lactic Acid Metabolism*. Annals of the New York Academy of Sciences, 1965, roč. 119, čís. 3, s. 957–973. Dostupné online [cit. 2019-03-09]. ISSN 1749-6632. DOI: 10.1111/j.1749-6632.1965.tb47455.x. (po anglicky)
- ScienceDirect [online]. www.sciencedirect.com, [cit. 2019-03-09]. Dostupné online.
- GLYCOLS - PROPYLENE GLYCOLS Dow Chemical Company (po anglicky, PDF)
- Langzeitige toxizität von propylenglycol in ratten British Industrial Biological Research Association na Science Direct (po anglicky, francúzsky a nemecky)
- A guide to glycols Dow Chemical Company (po anglicky)
- 1,2-Dihydroxypropane SIDS Initial Assessment Profile (po anglicky, archivované na Wayback Machine)
- Propylene glycol (PIM 443) INCHEM (po anglicky)
- SPETH, P.; VREE, T.; NEILEN, N.. Propylene Glycol Pharmacokinetics and Effects after Intravenous Infusion in Humans. Therapeutic Drug Monitoring, 1987-09-01, roč. 9, čís. 3, s. 255 – 258. PMID 3672566. Dostupné online [cit. 2019-03-09]. ISSN 0163-4356. (ENGLISH)
- BOSSAERT, L.; BROE, M. E. De; DAELEMANS, R.. PROPYLENEGLYCOL INTOXICATION DUE TO INTRAVENOUS NITROGLYCERIN. The Lancet, 1984-06-16, roč. 323, čís. 8390, s. 1360. Dostupné online [cit. 2019-03-09]. ISSN 0140-6736. DOI: 10.1016/S0140-6736(84)91860-9. (English)


-Propanediol_from_D-Mannitol.png.webp)