Heterocyklická zlúčenina
Heterocyklická zlúčenina je pomenovanie organickej zlúčeniny, ktorej molekula je tvorená aspoň jedným uhlíkovým cyklom, v ktorom sa však priamo v cykle okrem uhlíka nachádza aj iný prvok, napríklad kyslík, síra, dusík (najčastejšie), vzácnejšie aj fosfor, selén, telúr a iné. Takýto cyklus sa nazýva heterocyklus a neuhlíkový atóm v ňom sa nazýva heteroatóm; slovo heterocyklus sa alternatívne používa aj ako synonymum výrazu heterocyklická zlúčenina.
Delenie heterocyklických zlúčenín
Heterocyklické zlúčeniny možno rozdeliť z viacerých hľadísk, čo vyplýva z toho, že v heterocykle môže byť nielen jeden, ale aj viac heteroatómov, ktoré môžu byť vo vzájomných rôznych polohách. Heterocyklické zlúčeniny môžu obsahovať aj viacej cyklov, z ktorých nie každý (ale aspoň jeden) musí obsahovať heteroatóm.
Zlúčeniny s heteroatómami len jedného prvku, môžeme ich rozdeliť na:
- kyslíkaté
- sírnaté
- dusíkaté
Ak zlúčenina obsahuje len jeden heterocyklus, podľa počtu atómov v tomto cykle rozlišujeme:
- trojčlánkové
- štvorčlánkové
- päťčlánkové
- šesťčlánkové
Ich chemické vlastnosti sú podobné vlastnostiam benzénu.
Využitie
Skoro všetky heterocykly sú prírodného pôvodu. tvoria základné štruktúry živého organizmu. Všetky syntetické heterocykly sa získavajú z ropy.
Trojčlánkové heterocykly
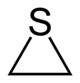
Z trojčlánkových heterocyklov sú stabilné len tie, ktoré obsahujú jeden heteroatóm. V porovnaní s inými heterocyklami sú veľmi reaktívne. Najbežnejšie trojčlánkové heterocykly sú:
| heteroatóm | nasýtený | nenasýtený |
|---|---|---|
| Dusík | aziridín | |
| Kyslík | oxirán (etylénoxid) | |
| Síra | etylénsulfid |
Štvorčlánkové heterocykly
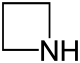
| heteroatóm | nasýtené | nenasýtené |
|---|---|---|
| Dusík | azetidín | |
| Kyslík | oxetán |
Päťčlánkové heterocykly
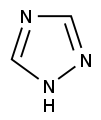
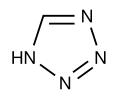
Päťčlánkové s 1 heteroatómom
| heteroatóm | nasýtené | nenasýtené |
|---|---|---|
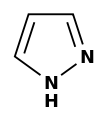
| Dusík | pyrolidín | pyrol |
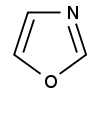
| Kyslík | tetrahydrofurán | furán |
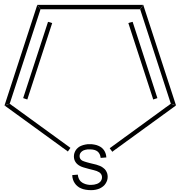
| Síra | tetrahydrotiofén | tiofén |
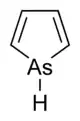
| Arzén | arzol |
Furán
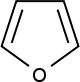
- Hlavný článok, pozri Furán.
V heterocykle obsahuje atóm kyslíka. Je bezfarebný, kvapalný, vo vode málo rozpustný. Zápach má podobný ako chloroform. Obsahuje atóm kyslíka a preto sa ľahko poskytuje voľný elektrón do reakcie. Využíva sa na tvorbu polymérov.
Pyrol
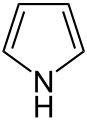
Z gréčtiny Phyros - červený. Nachádza sa v dechte, v kostiach, rohovine a prakticky vo všetkých látkach ktoré sú obsiahnuté v bielkovinách. Je veľmi slabá zásada až kyselina. Má schopnosť zafarbiť pravé smrekové drevo na ohnivú červeň aj napriek tomu, že drevo bolo namočené v kyseline chlorovodíkovej (HCl).
Z pyrolového kruhu sa odvodzujú deriváty pyrolu:
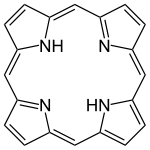
- Porfín(aj ako Prolín) (základ pre zlúčeninu HEM (krvné farbivo), tvoriacu hemoglobín)
- 4 hydroxyprolín
- Indol (súčasť indiga, aminokyseliny Tryptofánu a alkaloidov; vôňa ako jazmín)
Šesťčlánkové heterocykly
Šesťčlánkové s 1 heteroatómom
| heteroatóm | nasýtené | nenasýtené |
|---|---|---|
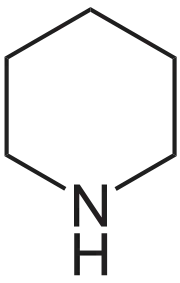
| Dusík | piperidín | pyridín |
| Kyslík | pyrán | |
| Síra | tiopyrán |
Pyridín
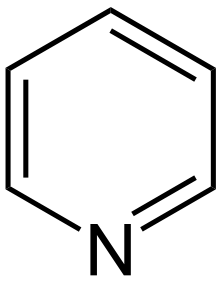
- Hlavný článok, pozri Pyridín.
Pyridín je zásaditý, kvapalný a vo vode rozpustný. Nachádza sa v čiernouhoľnom dechte. Zúčastnuje sa na elektrofilných substitúciach. Pyridínový kruh sa nachádza aj napríklad v kyseline barbiturovej, ktorá je súčasťou barbiturátov.
Deriváty pyridínu sú:
- kyselina nikotínová
- kyselina izonikotínová
- Tymín
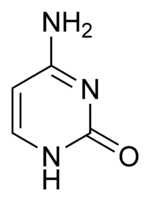
- Cytozín
Chinolín
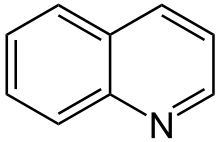
- Hlavný článok, pozri Chinolín.
Nachádza sa v dechte. Je zle rozpustný vo vode.
Derivát chinolínu je chinilín.
Šesťčlánkové s 2 a viac heteroatómami
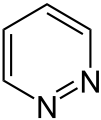 Pyridazín
Pyridazín
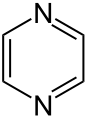 Pyrazín
Pyrazín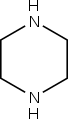 Piperazín
Piperazín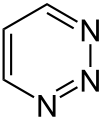 1,2,3-triazín
1,2,3-triazín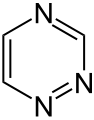 1,2,4-triazín
1,2,4-triazín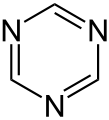 1,3,5-triazín
1,3,5-triazín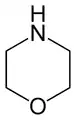 morfolín
morfolín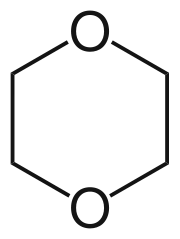 Dioxán
Dioxán
Zložitejšie heterocykly
Existuje veľké množstvo zložitejších heterocyklov. Mnohé sú základom alkaloidov Tu je prehľad niektorých z nich:
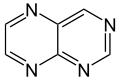 Pteridín
Pteridín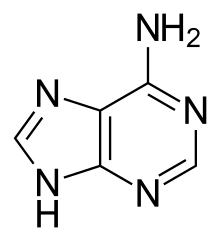
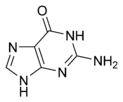
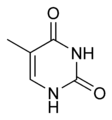
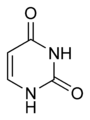
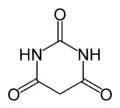 Kyselina barbiturová
Kyselina barbiturová
| Chemický portál |