Tetrahydrofurán
Tetrahydrofurán (THF) alebo oxolán je heterocyklická organická zlúčenina. Je to bezfarebná kvapalina, ktorá je miešateľná s vodou. THF je polárny a má veľký rozdiel medzi teplotou topenia a teplotou varu, čo ho robí užitočným rozpúšťadlom. Používa sa najmä ako prekurzor na výrobu polymérov.
| Tetrahydrofurán | |||||||||||||||||||||||||||
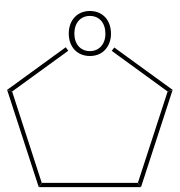 Tetrahydrofurán | |||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||
| Sumárny vzorec | C4H8O | ||||||||||||||||||||||||||
| Synonymá | oxolán, oxacyklopentán, tetrametylénoxid | ||||||||||||||||||||||||||
| Vzhľad | bezfarebná kvapalina | ||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||
| Molárna hmotnosť | 72,11 g/mol | ||||||||||||||||||||||||||
| Teplota topenia | −108.4 °C (−163.1 °F, 164.8 K) | ||||||||||||||||||||||||||
| Teplota varu | 66 °C (151 °F, 339 K) | ||||||||||||||||||||||||||
| Hustota | 0,8892 g/cm3 (pri 20°C) | ||||||||||||||||||||||||||
| Rozpustnosť | miešatelný s vodou | ||||||||||||||||||||||||||
| Teplota vzplanutia | −14 °C (7 °F, 259 K) | ||||||||||||||||||||||||||
| Medze výbušnosti | 2%–11,8%[1] | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||
Výroba
Ročne sa vyrobí približne 200 000 ton tetrahydrofuránu. Najbežnejšie sa vyrába pomocou dehydratácie 1,4-butándiolu. Butándiol sa vyrába kondenzáciou acetylénu s formaldehydom a následnou hydrogenáciou. Ďalším spôsobom výroby, ktorý vynašla firma DuPont je oxidácia n-butánu na anhydrid kyseliny malónovej, z ktorého sa hydrogenáciou za prítomnosti katalyzátoru vyrába THF. Tretím najbežnejším priemyselným procesom na výrobu tetrahydrofuránu je hydroformylácia alylalkoholu a následnou hydrogenáciou na 1,4-butándiol. Tetrahydrofurán sa dá taktiež vyrobiť hydrogenáciou furánu za prítomnosti katalyzátoru.[2]THF je takisto možné vyrobiť z pentózy a jej izomérov aj keď tento spôsob výroby sa používa len zriedkavo.
Využitie
Výroba polymérov
Pri reakcii THF so silnými kyselinami vzniká polymér polytetrahydrofurán. Tento polymér sa využíva na výrobu na výrobu syntetických polyuretánových vlákien, ako napríklad Elastan.
Rozpúšťadlo
Priemyselne sa THF využíva ako rozpúšťadlo pre polyvinylchlorid (PVC). THF je aprotické ropúšťadlo, ktorého pomerná permitivita je 7,6.[3] Je miešatelný s vodou a pri dostatočne nízkych teplotách dokáže vytvárať pevný klatrát.[4]
Často sa využíva pri analýze polýmerov, napríklad na ich rozpúšťanie pred určením ich molekulovej hmotnosti pomocou gélovej chromatografie. Takisto sa dá využiť na rozpustenie zaschnutého PVC lepidla a na odmasťovanie a čistenie rôznych kovových predmetov. Svoje využitie má napríklad aj pri 3D tlači. Pokiaľ sa na tlač používa polymér PLA, THF sa môže použiť na prečistenie upchatých častí tlačiarne a takisto sa s ním dá výtlačku dodať lesk.
Laboratórne využitie
THF je obľúbené a často využívané laboratórne rozpúšťadlo. Je viac zásaditý ako dietyléter a preto vytvára silnejšie komplexy s lítnymi a horečnatými katiónmi a s bórovodíkom.[5] Takisto sa často využíva ako rozpúšťadlo pri hydroborácii ,rozpúšťadlo pre organokovové zlúčeniny a pre grignardove činidlá. Pokiaľ sa THF používa pri reakciách, ktoré sú citlivé na prítomnosť vody (napríklad s určitými organokovovými zlúčeninami), musí sa z neho odstrániť voda, väčšinou viacnásobnou destiláciou alebo pomocou molekulových sít.
Bezpečnosť
Tetrahydrofurán je nízko toxická zlúčenina, porovnatelnú s acetónom. Keďže dokáže rozpustit latex väčšinou sa s ním pracuje v nitrilových alebo neoprénových rukaviciach.
Najnebezpečnejšie na THF je jeho reakcia s kyslíkom, pri ktorej vznikajú výbušné peroxidy. Tento problém sa potláča stabilizáciou pomocou butylhydroxytoluénu. THF sa preto nikdy úplne všetok nedestiluje, aby sa predišlo koncentrovaniu výbušných peroxidov.
Referencie
- https://www.cdc.gov/niosh/npg/npgd0602.html
- http://www.orgsyn.org/demo.aspx?prep=cv2p0566
- https://web.archive.org/web/20100316211430/http://www.cem.msu.edu/~reusch/VirtualText/enrgtop.htm#top4
- https://web.archive.org/web/20110711000808/http://gashydrate.fileave.com/NMR-MRI%20study%20of%20clathrate%20hydrate%20mechanisms.pdf
- https://pubs.acs.org/doi/abs/10.1021/ar960300e


